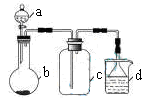
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸(70%) | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
①配制100mL一定浓度的溶液需用到的仪器有(填字母)。

②配制溶液时,需要将
固体溶解在浓盐酸中,原因为。
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液的体积为20.00mL,已知:
, 则该
溶液的浓度为
。
预测现象1:向溶液中加入
溶液,溶液由黄色变为浅绿色。作出该预测的原因为(用离子方程式表示)。
预测现象2:向溶液中加入
溶液,生成红褐色沉淀。
序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 20 | |
0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 | |
38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 | |
现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
①请补充表格中的数据:a=。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是。
③实验ⅵ和ⅶ的实验现象说明溶液中的水解与
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:。
④甲同学认为实验ⅵ和ⅶ中,与
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(填实验操作与现象),则说明猜想成立。
已知:与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
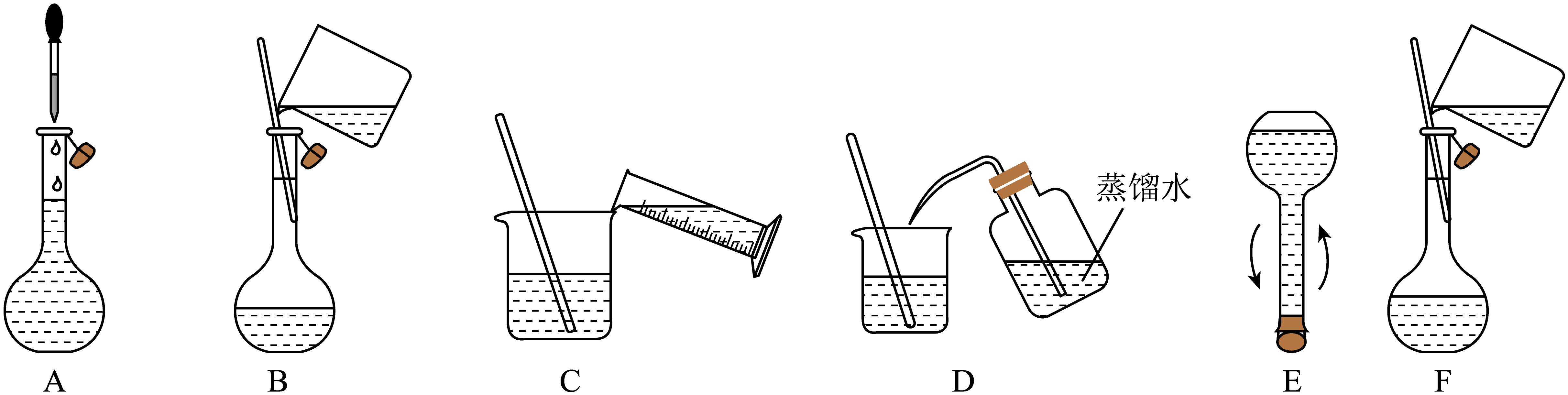
①配制480 mL 0.1 mol/L的标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、。
②将下述实验步骤A到F按实验过程先后次序排列。
①用量取220.00 mL 0.017 mol/L 溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是。
③如何判定滴定结束?。
④列式并计算标准溶液
![]() 浓度。
浓度。
| KI溶液 | ||
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?。
②写出溶液与KI反应的离子方程式。
提出问题:与
是可逆反应,
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出与
反应的离子方程式:。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用溶液进行标定,发现消耗的
溶液体积相同。
实验小结:是否会影响滴定:。


回答下列问题:
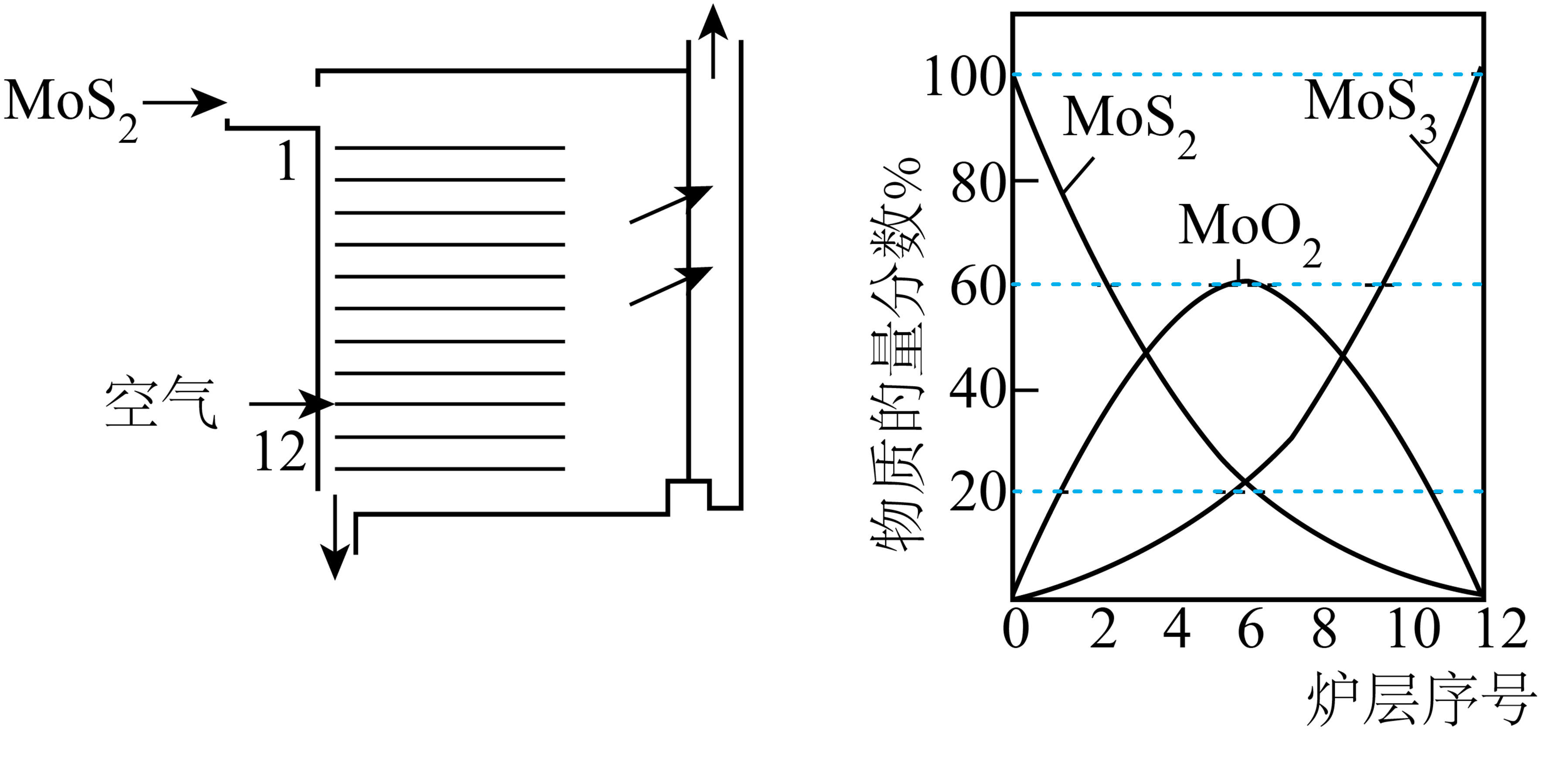
①多层逆流焙烧的优点是(任答一点)。
②固体1的成分有、CuO和Fe2O3。
A | B | C | D |
|
|
|
|
验证双液原原电池的工作原理 | 比较C与Si的非金属性强弱 | 用电石制备乙炔并验证乙炔的性质 | 探究铜与浓硫酸的的反应 |
()→()→a→()→e→f→()
a.调节三通阀如图![]() , 收集气体一段时间
, 收集气体一段时间
b.开启装置A磁力搅拌器,慢慢加入一定量硫酸
c.调节装置B温控磁力搅拌器,并控制温度为30℃
d.调节装置B温控磁力搅拌器,并迅速控温在85℃
e.调节三通阀如图![]()
f.移动水准管并调节活塞Y控制气体流速,反应一段时间后
g.检测气体纯净后连接三通阀
A.冷水 B.热水 C.乙醚 D.滤液
滴定反应:
主要步骤:
Ⅰ.称取mg产品用蒸馏水溶解并定容至500mL。移取该溶液注入碘量瓶中,加
碘标准液,20mL氢氧化钠溶液,于暗处放置10min。加适量水及盐酸摇匀,用
硫代硫酸钠标准溶液滴定,近终点时,加3mL淀粉指示液 , 继续滴定至终点,消耗体积
。
Ⅱ.空白实验:将上述样品溶液改为蒸馏水注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
。
①需要加入淀粉指示液时,锥形瓶中溶液的现象是。
②产品的质量分数为。
