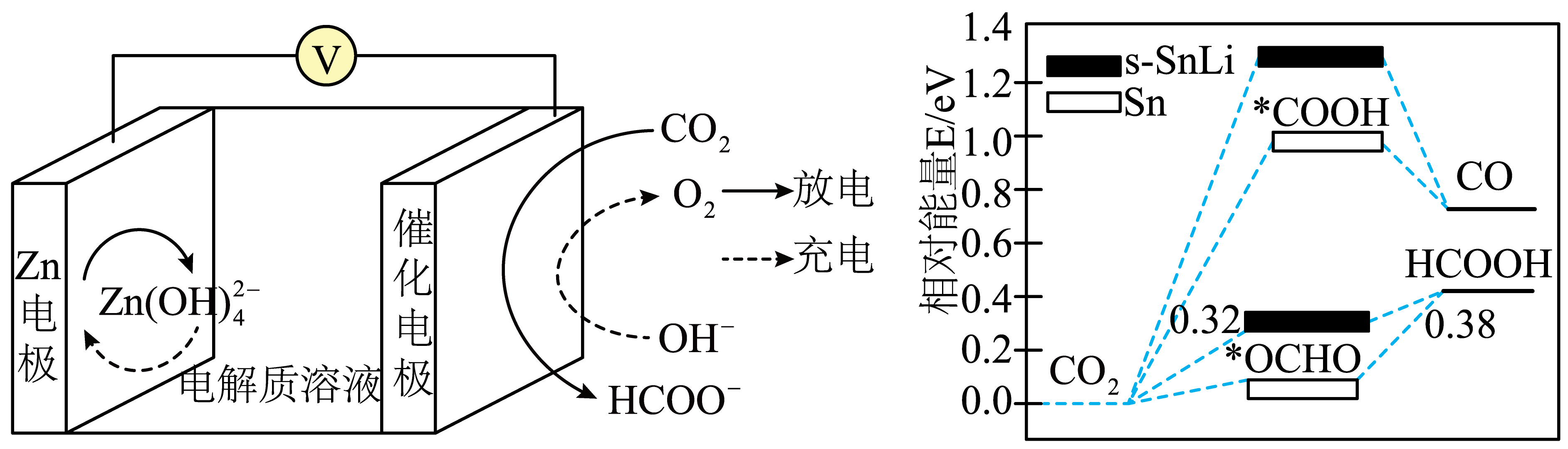

已知:①几种物质的部分性质如表所示。
物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
乙酸乙酯 | 77.2 | 88 | 微溶 |
乙酰乙酸乙酯 | 181(温度超过95℃,易分解) | 130 | 微溶 |
乙酸 | 118 | 60 | 易溶 |
②10乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇。③
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
回答下列问题:


已知:可溶于水
和
都是酸性氧化物。
以石墨为阳极,“电解”时阴极的电极反应式为,阳极产生的气体是(填化学式)。
|
|
A.分离二氯甲烷和四氯甲烷 | B.提纯含有少量氯化钠和泥沙的苯甲酸 |
|
|
C.用电石与水反应制取乙炔 | D.比较乙酸、碳酸和苯酚 |

已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于或等于)时的pH如下表。
离子 | |||
开始沉淀的pH | 7.6 | 1.9 | 4.4 |
完全沉淀的pH | 9.6 | 3.1 | 5.6 |

①该晶胞中含铬原子的个数为。
②铬原子的配位数为。
③铬原子之间的最短距离为nm(用含a的代数式表示)。

向三颈瓶中通入C发生反应,一段时间后向其中加入适量NaCN溶液,充分反应后可得含有CuCN的浊液。

①写出三颈烧瓶中生成CuCN的总反应的化学方程式:。
②实验结束时向装置中通入 , 该实验操作的目的是。
皿。产品纯度测定
mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
硫酸铈
标准溶液滴定至终点,消耗
溶液bmL。产品中CuCN的质量分数为。(不用化简,用上述字母列出表达式。已知:
)
下列有关滴定的说法错误的是(填字母)。
A.未用标准溶液润洗滴定管会使测定结果偏低
B.锥形瓶要用待测溶液润洗
C.在接近终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前正确读数,滴定后仰视读数,会使测定结果偏低