①CO的平衡转化率a=;T1℃时,反应平衡常数k=(保留2位有效数字)。
②由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系如图1所示。若升高温度,反应重新达到平衡,则v正~x(CO)相应的点变为、v逆~x(H2)相应的点变为。


间接制取低碳烯烃:CO(g)+2H2(g)CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
回答下列问题:




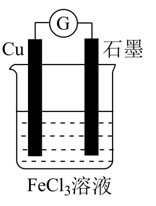
下列说法错误的是( )
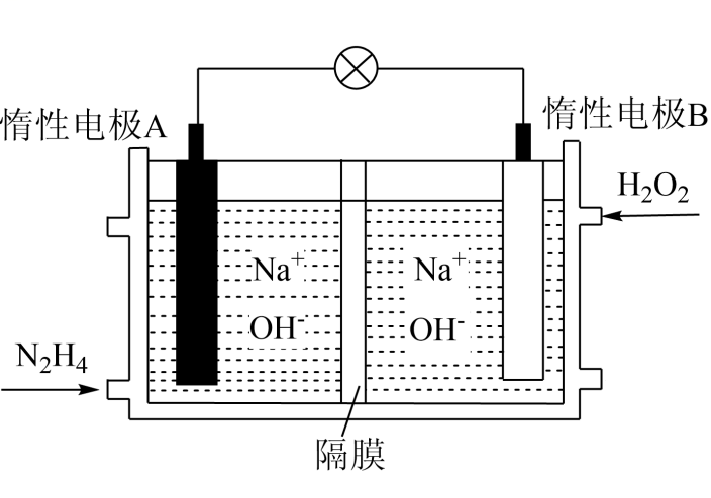
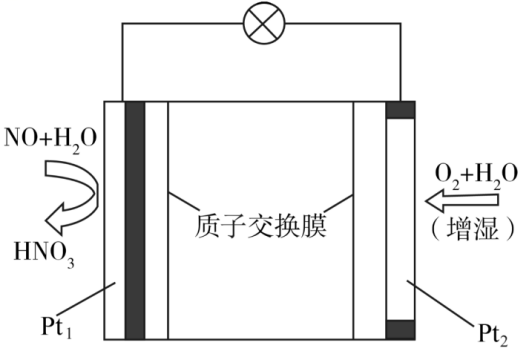
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。