
![]()
若A、B、C含同一金属元素,X为电解质溶液,可电离出OH- , 所有反应都在溶液中进行。B的化学式为,X中溶质的化学式为。
 C . Mg的原子结构示意图:
C . Mg的原子结构示意图: D . CS2的结构式:S=C=S
D . CS2的结构式:S=C=S
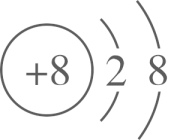 B . 基态铜原子价电子的轨道表示式:
B . 基态铜原子价电子的轨道表示式: (正四面体形)
D .
(正四面体形)
D . | 元素 | 结构或性质信息 |
| W | 原子L层上s电子数等于p电子数 |
| X | 同周期主族元素中电负性最小 |
| Y | 第三周期的主族元素中简单离子的半径最小 |
| Z | 单质在常温、常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 前四周期中基态原子核外未成对电子数最多 |
请根据信息回答有关问题:
在周期表中与Y元素的化学性质最相似的短周期主族元素是,该元素基态原子核外共有种能量不同的电子。
A.![]() B.
B.![]()
C. D.
D.![]()


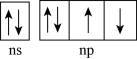 (
(