从图1中选择符合图2要求的X代表的物质:X。



装置乙的作用是。若X为品红溶液,观察到溶液褪色,说明SO2具有(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
a.氧化性 b.还原性 c.漂白性 d.酸性
Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-++H+
物质 | 肼 | 偏二甲肼 |
熔点 | 1.4℃ | -58℃ |
沸点 | 113.5℃ | 63.9℃ |
二者熔沸点差异较大的主要原因是。
 )反应的部分历程为
)反应的部分历程为 。
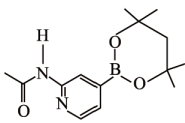
。①乙酰氯分子中碳原子的杂化类型为。
②乙酰氯分子中C-C键与C-Cl键的夹角 120°(填“大于“等于”或“小于”), 判断理由是。
③的空间构型为。




物质 | A(对氨基苯甲酸) | B(邻氨基苯甲酸) |
结构简式 |
|
|
熔点 | 188℃ | 145℃ |
作用 | 防晒剂 | 制造药物及香料 |
①组成物质A的4种元素的电负性由大到小的顺序是。
②A的熔点高于B的原因是。
③A可以与多种过渡金属元素形成不同结构的配合物。其中A和可形成链状结构,在下图虚线内画出A的结构简式 。
![]()

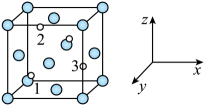
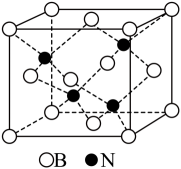
①基态Ni原子价层电子的轨道表示式为。
②与Zn原子距离最近且相等的Ni原子有个。
③表示阿伏加德罗常数的值。若此晶体的密度为
, 则晶胞的边长为nm。(
)
①P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。
②P与N的氢化物空间构型相似,PH3键角NH3键角(填“>”“<"或“=”)。
A.离子键 B.金属键 C.氢键 D.共价键 E.配位键

已知原子O、A的分数坐标为(0,0,0)和(1,1,1),原子B的分数坐标为,若该晶体密度为dg·cm-3 , 则铜镍原子间最短距离为pm(列出计算式,设NA为阿伏加德罗常数的值)
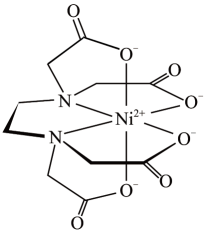
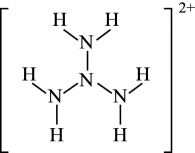
1个该配合物中通过螯合作用形成的配位键有个,在形成配位键前后C-N-C键角将(填“增大"“减少”或“不变”)。
 B . 乙醛空间填充模型:
B . 乙醛空间填充模型: C . 反式聚异戊二烯结构简式:
C . 反式聚异戊二烯结构简式: D . 基态铬原子的价层电子排布式:
D . 基态铬原子的价层电子排布式: