①
②
总反应的

①内,
,
的平衡转化率为%。
②该反应的平衡常数。

①铜电极上产生的电极反应式为。
②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4 , 此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为。
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
反应A:4HCl+O22Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
参加反应的物质及状态 | |||
1mol分子中的化学键断裂时需要吸收的能量 | 436 | a | 369 |
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1 , 蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:。
①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:。
物质 | |||
②。
则③中的
(用含
的式子表示),
(用含
的式子表示),该反应中每消耗
, 此时转移的电子数为
。
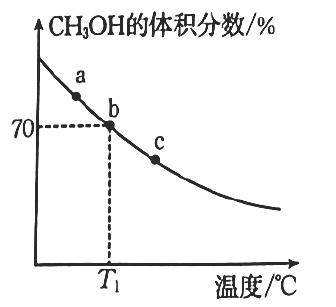
①下列有关反应的说法正确的是(填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大的平衡转化率
D.无论反应进行到何种程度,为某一定值
②平衡常数由大到小的顺序为。
③反应速率:(填“>”“<”或“=”)
。
④ , b点的平衡常数
。
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
① 0-5 min内,以N2表示该反应速率v(N2)= mol·L-1·min-1 , 第15 min后,将温度调整为T2 , 数据变化如上表所示,则T1 T2(填“>、< 或 =”)。
② 若为绝热恒容容器,下列表示该反应已达到平衡状态的是(填字母)。
A.混合气体的密度不再变化 B.温度不再变化
C.NO和的消耗速率之比为1:2 D.混合气体中c(NO) = c(N2)

图中a、b、c三点,达到平衡的点是。
ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。
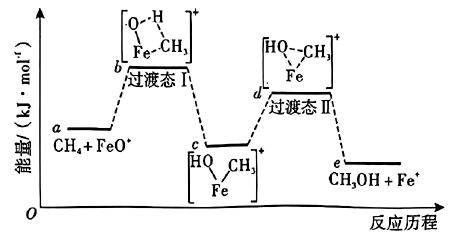
说明:过渡态中“--”表示化学键未完全断裂或形成。