
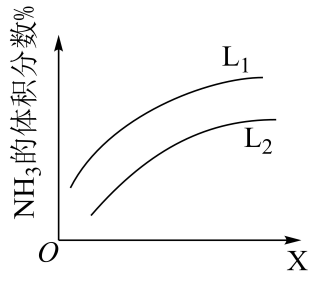
①表示水碳比(S/C)=4的曲线是(填“a”或“b”),该水碳比下制氢的最佳温度是。
②水碳比(S/C)=2时,(g)平衡产率随温度升高先增大后逐渐减小。
(g)平衡产率逐渐减小的原因可能是。
①体系中的物质的量为。
②反应Ⅱ的化学平衡常数K=。

②催化加氢制低碳烯烃,反应历程如下图所示,
首先在
表面解离成2个
, 随后参与到
的转化过程。

注:“□”表示氧原子空位,“*”表示吸附在催化剂上的微粒。
理论上反应历程中消耗的与生成的甲醇的物质的量之比为。

①(填“>”“<”或“=”)。
②下列说法正确的有。
A.b点时达到平衡状态
B.a点时容器内气体密度大于b点
C.平均相对分子质量不再改变时,该反应达到平衡状态
D.温度高于后
转化率下降,原因可能是该反应

①开始时,的分压
kPa;50min后反应到达平衡,用
的压强变化表示这段时间的平均反应速率
为
, 反应
的压强平衡常数
(列出算式即可)。
②保持温度不变,若增大压强,的转化率变化曲线将是(选填“丙”、“丁”或“戊”),请说明理由:。

I.以氨气作为还原剂,可除去烟气中的氮氧化物。已知下列反应:
①
②
③
有利于该反应自发进行的条件是(填“高温”“低温”或“任何温度”)。
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C.容器内的总压不变 D.

图中表示和
的曲线分别是(填上图字母),该反应的正反应是(填“吸热”或“放热”)反应。

图2
①时,通入
、
各
, 平衡时
的选择性、
的平衡转化率都为
, 平衡时生成
的物质的量为
, 此温度下反应I的平衡常数
(保留2位有效数字。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②区间,
平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:。

Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原。
已知:

要使该反应能自发进行,理论上温度不高于℃;
a.升高温度会使的平衡转化率降低
b.和
的转化率之比不再变化,说明反应达到平衡状态
c.若反应达到平衡后,再向容器中充入的反应物,则甲烷的体积分数仍保持不变
反应①:
反应②:
反应①和②在不同温度下的分压平衡常数如下表,回答下列问题:
反应① | 2.80 | |||||
反应② |
根据表中数据推出反应①的活化能(正)(填“
”或“
”)
(逆);

正极的电极反应式是;
图1  图2
图2
已知:
CO(g)+O2(g)=CO2(g);
煤气化时发生主要反应的热化学方程式是。
| |||
0 | 1.0 | 1.8 | 0 |
2min | 0.5 |
| 0.5 |
4min | 0.4 | 0.6 | 0.6 |
6min | 0.4 | 0.6 | 0.6 |
①前2min的反应速率。
②该温度下的平衡常数。(可用分数表示)
I.
II.
反应。(用
表示)
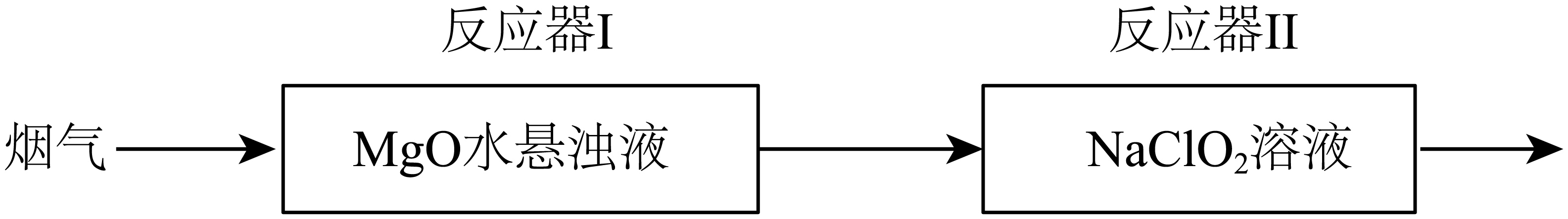
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式。
②反应器II中所发生的反应为 , 盛有
溶液最多能吸收
(标准状况下)的体积为。
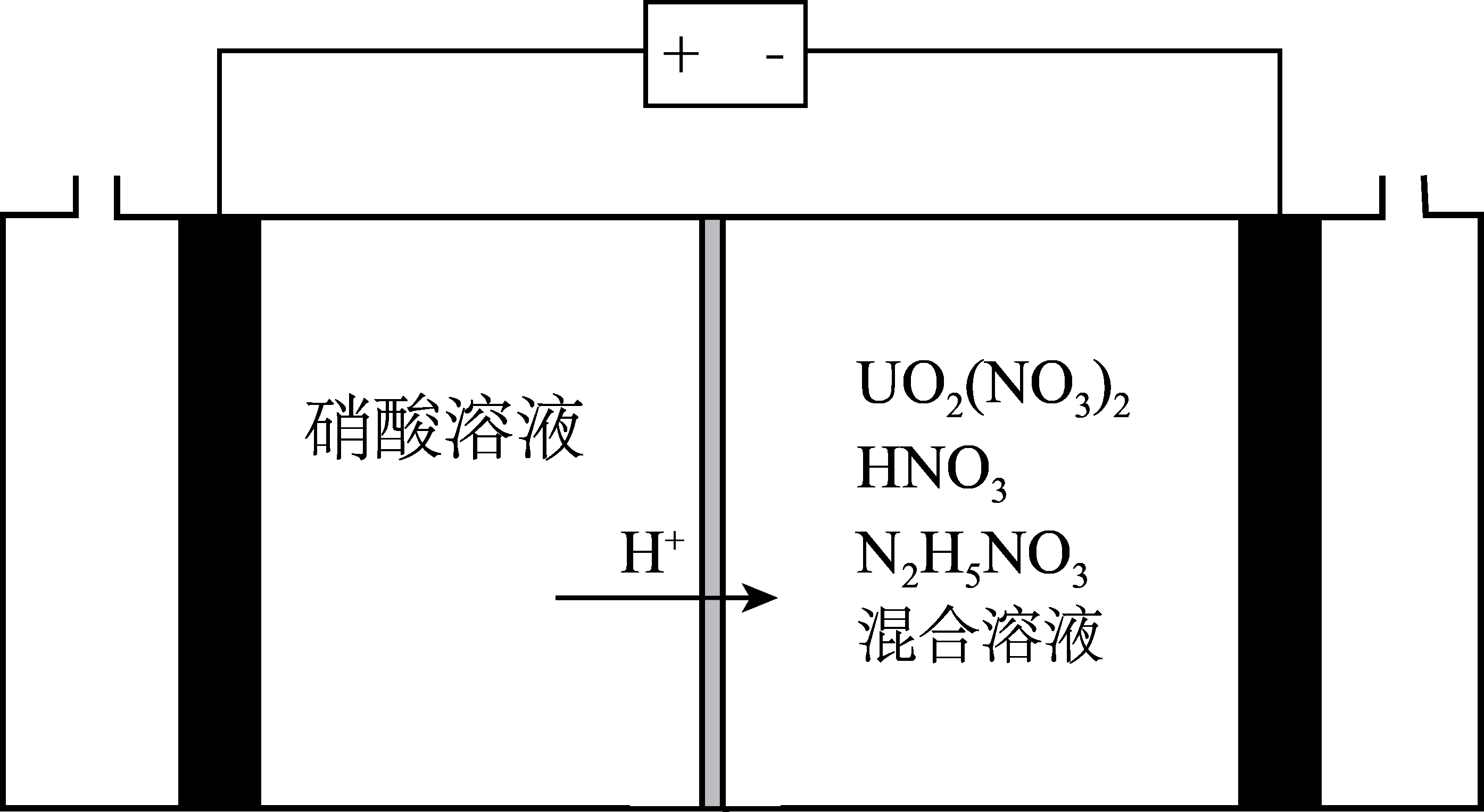
阴极发生的反应为: , 阴极区溶液中发生反应:
、
。
①阴极上发生的副反应为:。
②阴极区溶液中加入的目的是。
③电还原处理+6价的铀转移
, 阴极区
减少mol。