I.以氨气作为还原剂,可除去烟气中的氮氧化物。已知下列反应:
①
②
③
有利于该反应自发进行的条件是(填“高温”“低温”或“任何温度”)。
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C.容器内的总压不变 D.

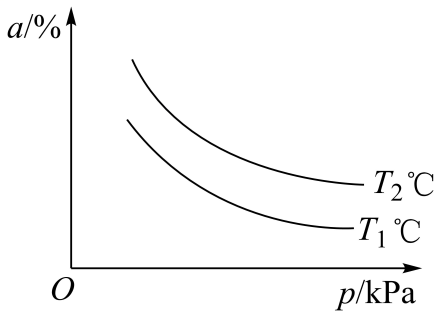
图中表示和
的曲线分别是(填上图字母),该反应的正反应是(填“吸热”或“放热”)反应。

图2
①时,通入
、
各
, 平衡时
的选择性、
的平衡转化率都为
, 平衡时生成
的物质的量为
, 此温度下反应I的平衡常数
(保留2位有效数字。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②区间,
平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:。

Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原。
已知:

要使该反应能自发进行,理论上温度不高于℃;
a.升高温度会使的平衡转化率降低
b.和
的转化率之比不再变化,说明反应达到平衡状态
c.若反应达到平衡后,再向容器中充入的反应物,则甲烷的体积分数仍保持不变
反应①:
反应②:
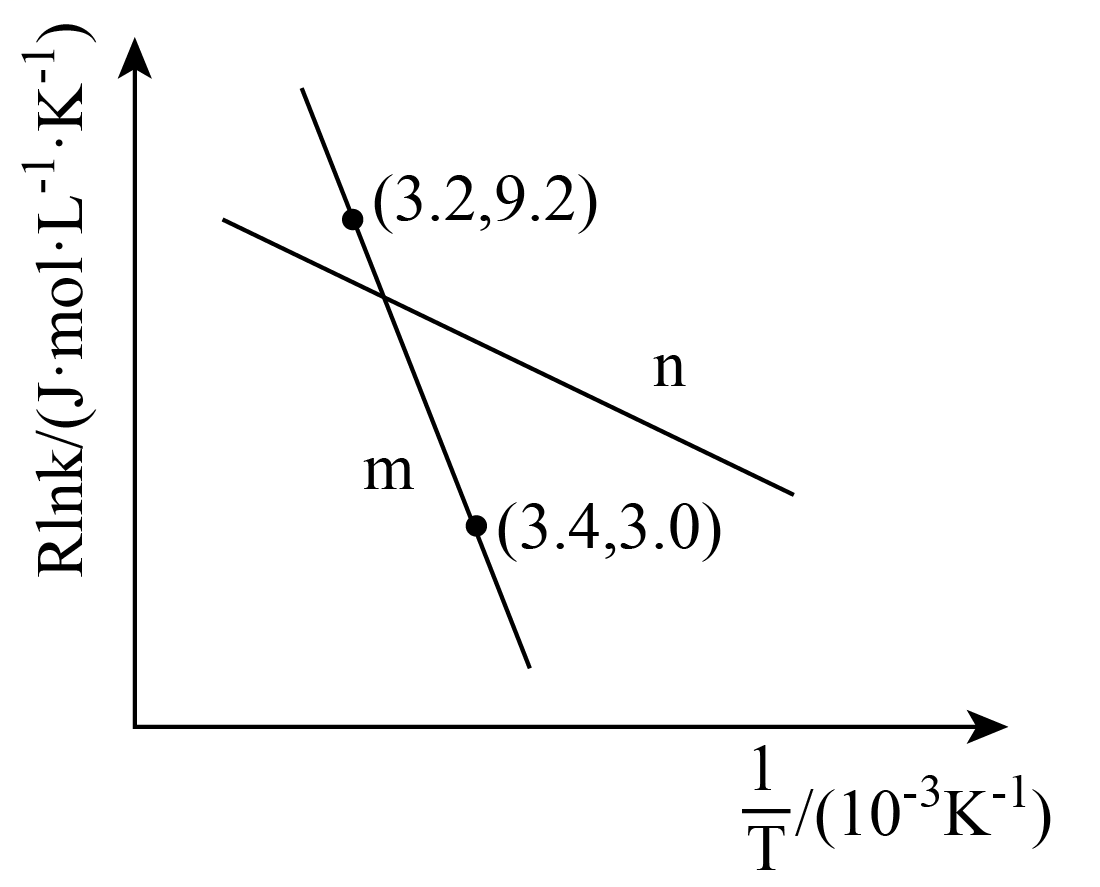
反应①和②在不同温度下的分压平衡常数如下表,回答下列问题:
反应① | 2.80 | |||||
反应② |
根据表中数据推出反应①的活化能(正)(填“
”或“
”)
(逆);

正极的电极反应式是;

图1 图2
已知:
CO(g)+O2(g)=CO2(g);
煤气化时发生主要反应的热化学方程式是。
| |||
0 | 1.0 | 1.8 | 0 |
2min | 0.5 |
| 0.5 |
4min | 0.4 | 0.6 | 0.6 |
6min | 0.4 | 0.6 | 0.6 |
①前2min的反应速率。
②该温度下的平衡常数。(可用分数表示)
I.
II.
反应。(用
表示)
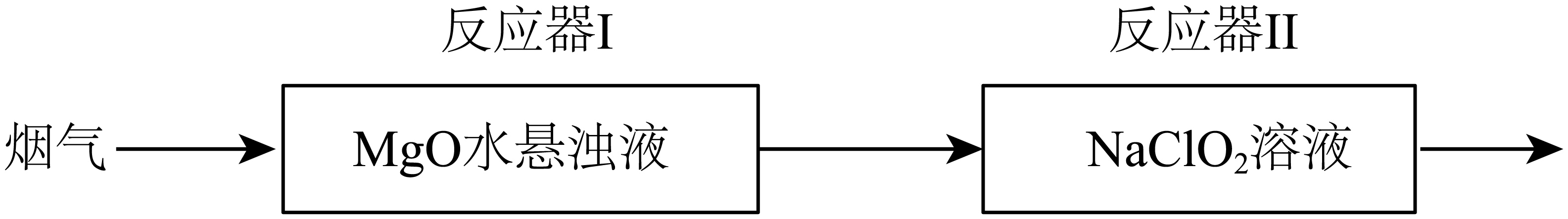
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式。
②反应器II中所发生的反应为 , 盛有
溶液最多能吸收
(标准状况下)的体积为。
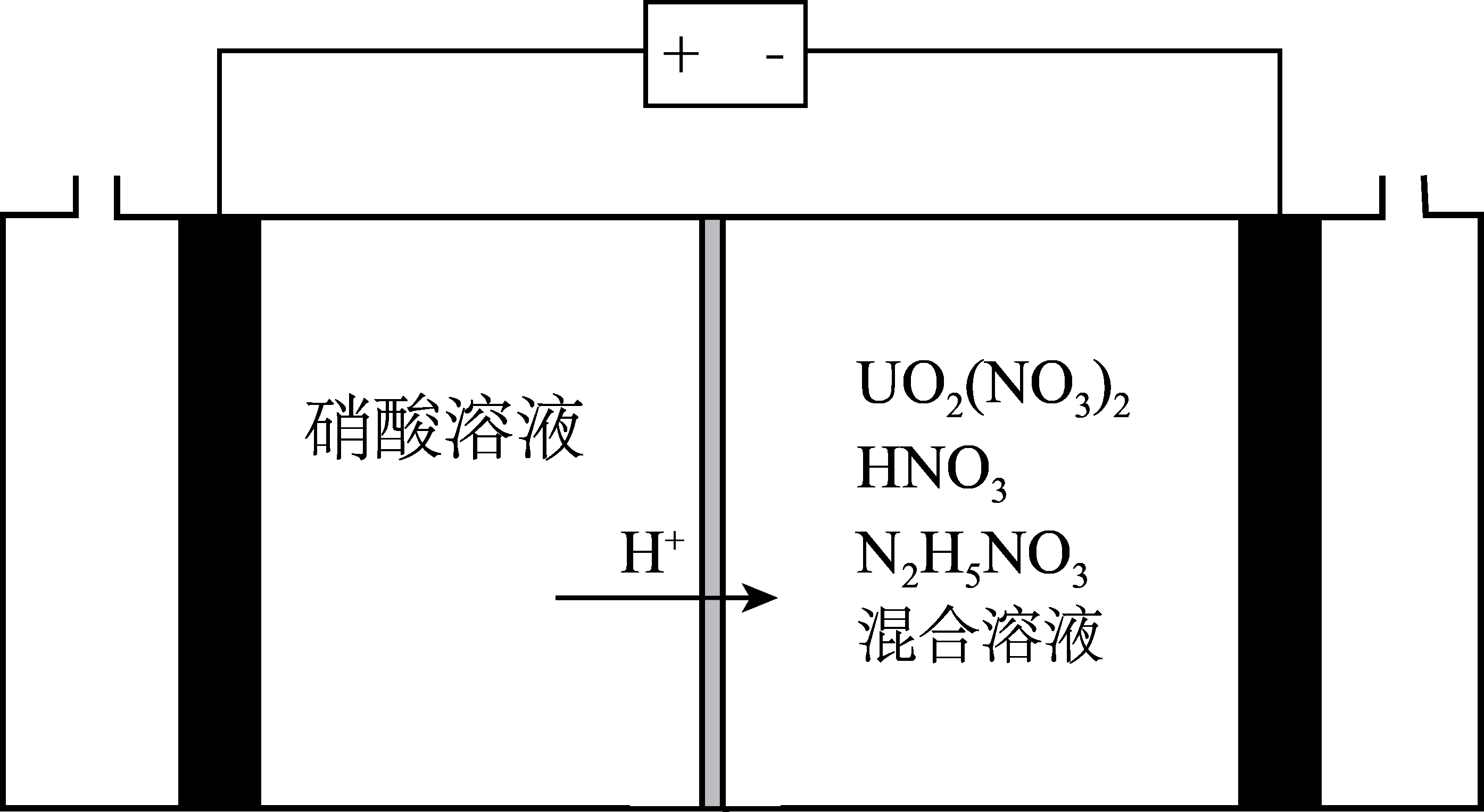
阴极发生的反应为: , 阴极区溶液中发生反应:
、
。
①阴极上发生的副反应为:。
②阴极区溶液中加入的目的是。
③电还原处理+6价的铀转移
, 阴极区
减少mol。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:
反应Ⅱ.逆水汽变换:
反应Ⅲ.甲醇脱水:
工艺2:反应Ⅳ.
① , 反应Ⅳ在(填“低温”“高温”或“任意温度”)下自发进行.
②反应Ⅳ的活化能(正)(填“>”“<”或“=”)
(逆).
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是(填标号).
A.气体物质中碳元素与氧元素的质量比不变
B.容器内浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变

图甲 图乙
①下列说法正确的是(填标号).
A.图甲纵坐标表示的平衡产率
B.
C.为了同时提高的平衡转化率和
的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是.
①反应经过达到平衡,
内
的平均反应速率
.
②温度时反应Ⅰ的平衡常数
.

已知部分化学键的键能数据如下:
共价键 | |||||
键能 | 413 | 497 | 462 | 351 | 348 |
根据上述信息,写出该催化反应的热化学方程式。
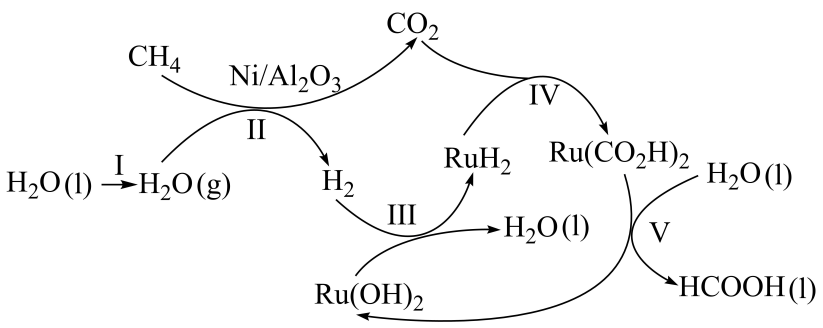
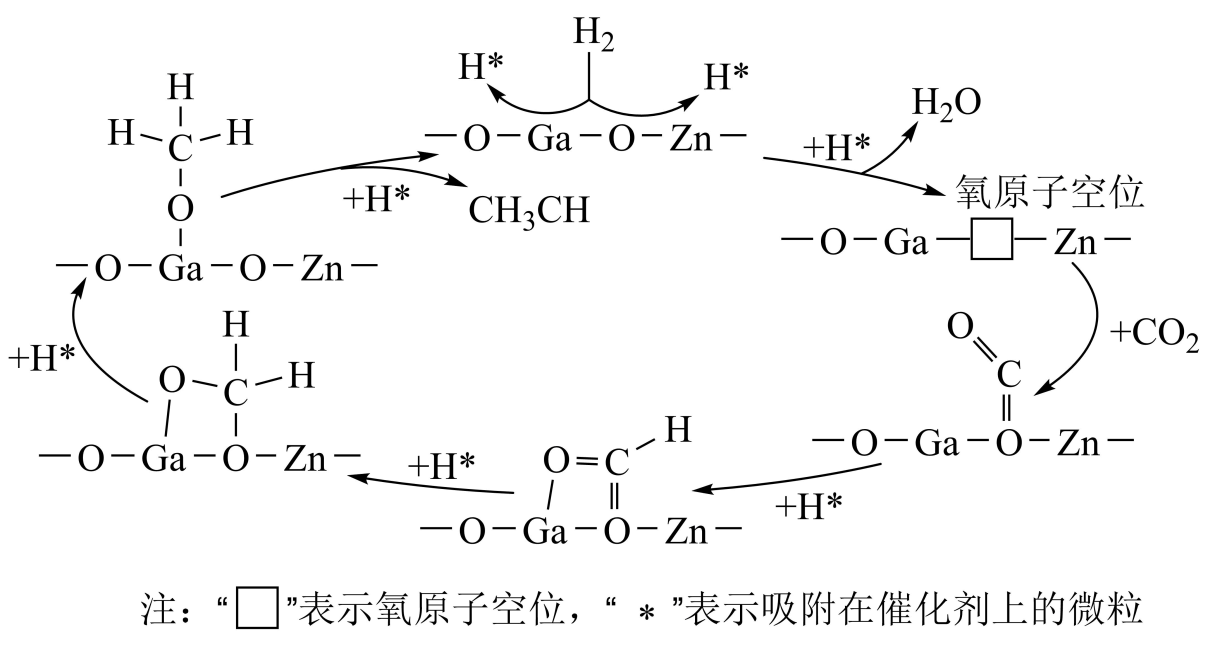
①上述历程中除制得甲酸外,还可得到的副产品为。
②已知上述步骤Ⅱ反应的。一定温度下,向
恒容密闭钢瓶中充入
和
, 在催化剂作用下发生步骤Ⅱ的反应。
末达到平衡,测得钢瓶中
的物质的量为
。
内,平均反应速率
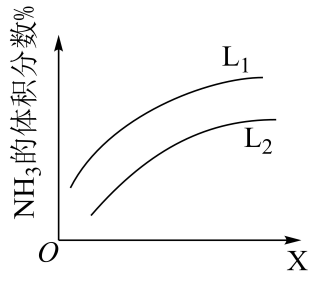
。改变条件重复实验,测得
的平衡转化率
与温度
和压强
的关系如图所示,则
(填“>”“<”或“=”)。