

该反应是(填“放热”或“吸热”)反应,反应在(填“低温”或“高温”)下能自发进行。
平衡时,若、
与
三者的物质的量相等,则
转化率为,反应
平衡常数
(用含p的代数式表示)。
①
②
,
。
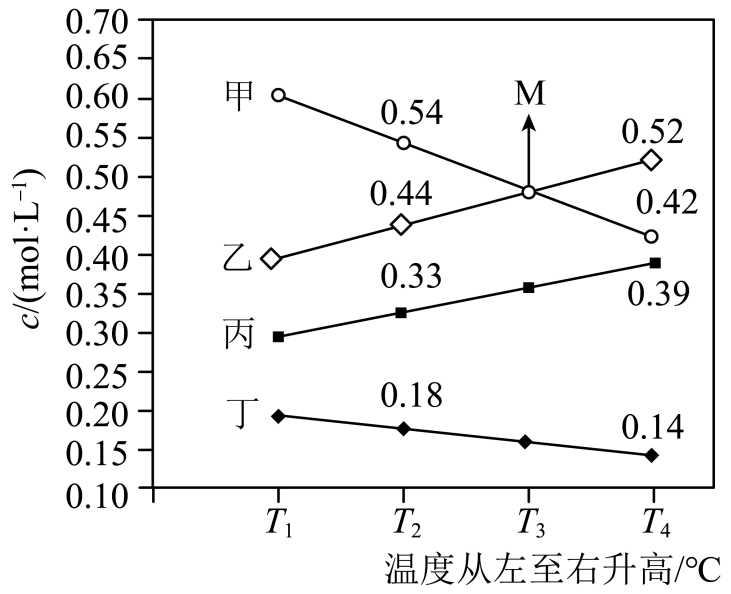
①甲是(填化学式),写出该反应的化学方程式:。
②正反应(填“>”“<”或“=”)0,判断依据是
③T3℃时NH3的平衡转化率为。



已知:①在标准状态下将1mol离子型晶体(如NaCl)拆散为1mol气态阳离子()和1mol气态阴离子(
)所需要
![]() 能量叫做晶格能,
能量叫做晶格能,的晶格能为
。
②Xe的第一电离能为。
③
。
根据以上信息,计算反应
。

已知:分压=总压×该组分物质的量分数;
对于反应
其中 ,
、
、
、
为各组分的平衡分压。
标准压强平衡常数 反应平衡 | ||
反应I: | 360 | |
反应II: | ||
反应III: |
①0(填“>”或“<”)。为提高平衡混合物中
的含量,应投料比
(填“增大”或“减小”)。
②673K时充人23.77molXe和 , 达平衡时容器内总压强
, 各产物
![]() 物质的量如下表所示:
物质的量如下表所示:
化学式 | |||
物质的量/mol | 3.60 | 19.80 | 0.36 |
则平衡转化率
(保留三位有效数字),
。
化学键 | C=O | H—O | H—H | C—O | C—H | C—C |
键能( | 803 | 463 | 436 | 326 | 414 | 348 |
依据表中数据计算的
H=
, 下列有利于该反应自发进行的条件是(填标号)。
A.高温 B.低温 C.任何温度

该反应中形成的化学键有____(填标号)。
a. b.容器中气体的平均摩尔质量不变
c.CH3CH2OH的百分含量保持不变 d.容器中混合气体的密度保持不变

①表示的曲线为(填标号)。
②、
、
由大到小的顺序是。
③℃、投料比为
下,该反应的平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

回答下列问题:
a.高压、高温 b.高压低温 c.低压、高温 d.低压低温
②已知CO2和H2可发生副反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41kJ•mol-1部分相关化学键的键能数据如表:
化学键 | H-H | C-O | H-O | C-H | C≡O |
E/(kJ•mol-1) | 436 | 326 | 464 | 414 | 1061 |
由此计算E(C=O)=kJ•mol-1。

①温度略为升高(从525K→550K),CO2的转化率明显增大的可能原因是。
②工业生产中,对于气相的反应体系,还可用反应体系中各组分的分压来表示化学平衡常数(Kp)。如反应:aA(g)+bB(g)dD(g)+eE(g)达到平衡时,Kp=
, 组分分压p(A)=P总×
。现保持550K、pkPa条件,CO2和H2按投料比(物质的量)1:9进行生成CH3OH反应,达到平衡时,CO2的转化率为α,则反应的化学平衡常数Kp=(列出含α、p计算式)。
温度/℃ | 220 | 240 | 250 | 255 |
BL/% | 60.2 | 84.6 | 92.6 | 95.2 |
| 1.2 | 1.8 | 1.9 | 2.1 |
| 0.2 | 0.3 | 0.4 | 0.6 |
已知:![]()
下列说法不正确的是( )