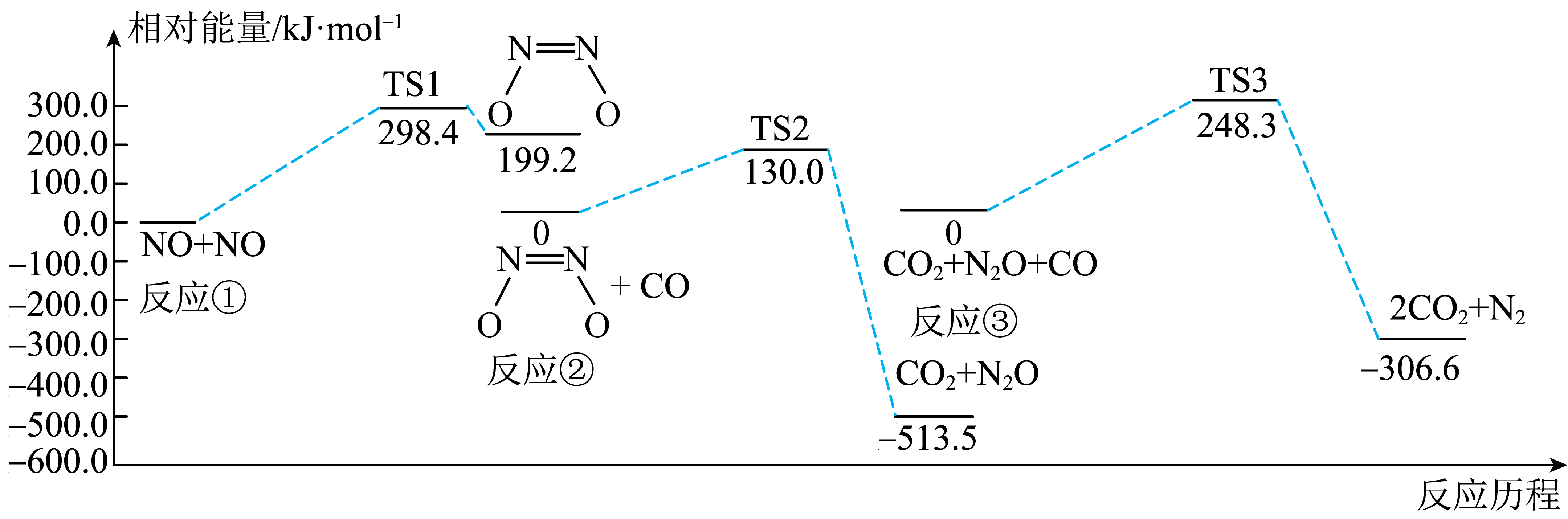
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。
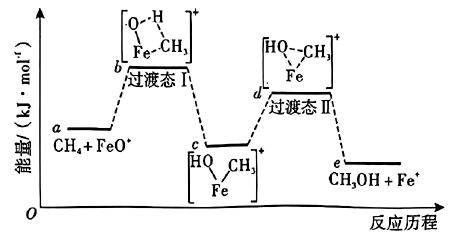
说明:过渡态中“--”表示化学键未完全断裂或形成。
①基态的3d电子轨道表示式为。
②的配位原子是,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是。
Ⅰ.
Ⅱ.
①反应
。
②不同温度下氨催化氧化的平衡常数如下();
温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( | 6.3×1041 | 1.1×1026 | 21×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
下列说法正确的是。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
第一步:
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
, 在一定条件下反应进行到10 min时,测得
和尿素的物质的量均为0.25 mol,15 min后,测得
的物质的量为0.1 mol,如图所示。
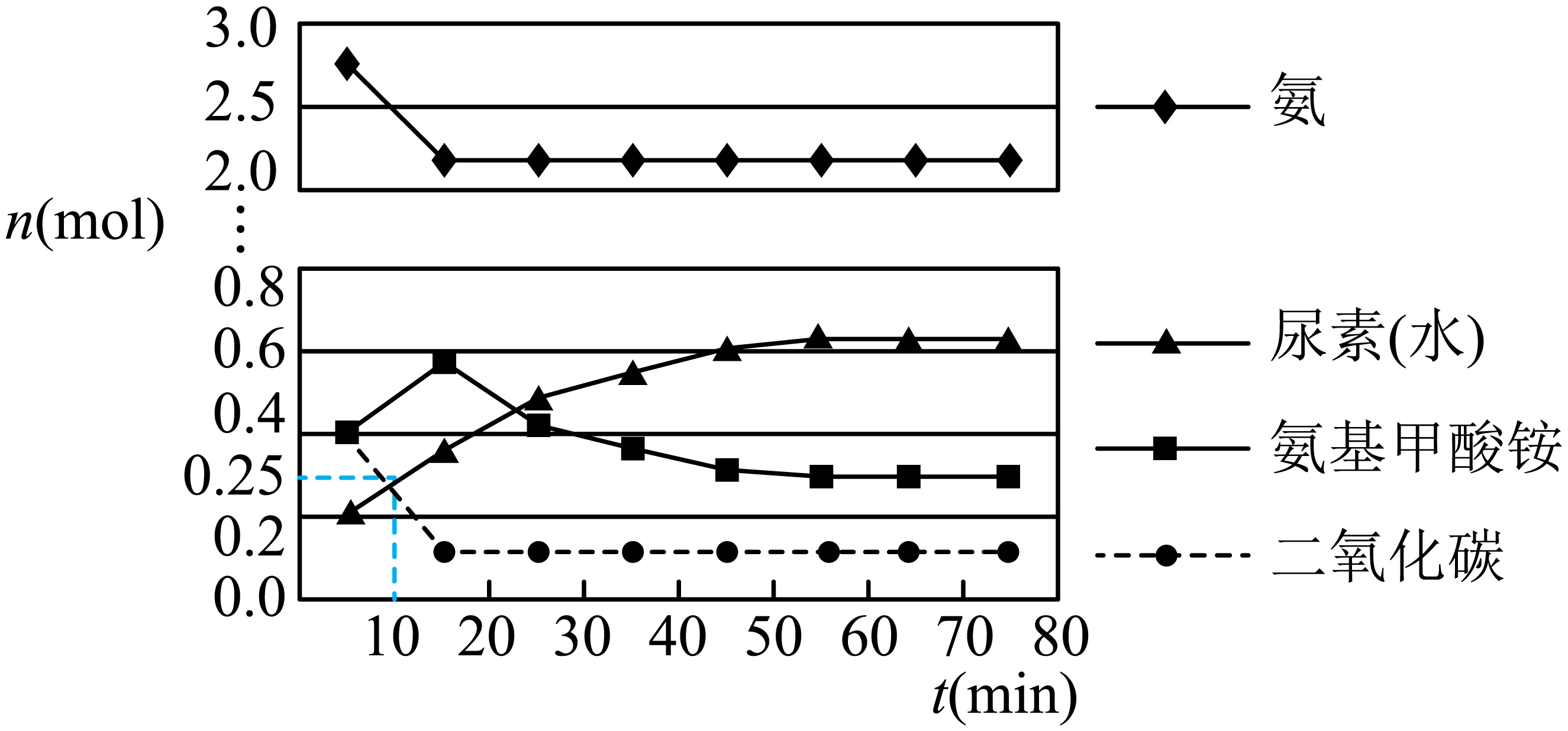
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成(氨基甲酸铵)的平均反应速率为。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是,第一步反应的平衡常数(列出算式即可)。
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 氨气的水溶液能导电 | 氨气是电解质 |
B | H—F键能比H—Cl键能大 | HF的沸点比HCl高 |
C | 工业合成氨需在高温、高压下才能进行 | 该反应是吸热反应 |
D | 浓硫酸具有吸水性 | 可用于 |
根据以下应用回答有关问题:
元环。试画出S8的八元环结构式。
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式。
共价键 | C=O | C=S | H—O | H—S |
键能/kJ.mol-1 | 745 | 536 | 464 | 339 |
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:.

①H2S2的名称是。
②电极b为(选填“正极”、 “负极”)。
③电极a上发生的电极反应为:。
该制备反应的化学方程式为;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式。
已知:①主要副反应为
②温度过高会引发烃裂解生成炭(C)。
③相关化学键的键能如下所示:
化学键 | ||||
键能 | 615 | 436 |
请回答:
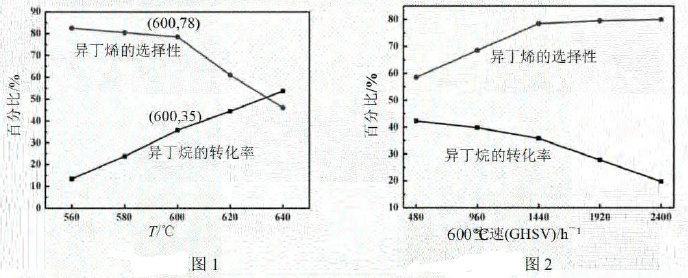
①图1中,600℃时异丁烯收率。
②下列说法正确的是。
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是。
④其他条件相同,异丁烷的平衡转化率如图3所示。若充入改为2mol,在图3中作出异丁烷的平衡转化率随温度变化的曲线(忽略积碳的影响)。
机理Ⅰ:C2H6→CH3CHO
机理Ⅱ:C2H6→CH3CH2OH→CH3CHO
机理Ⅲ:C2H6→C2H4→CH3CHO
已知下图是乙烷选择氧化生成乙醛的一种反应历程的过渡态、中间体和产物的稳定几何构型。
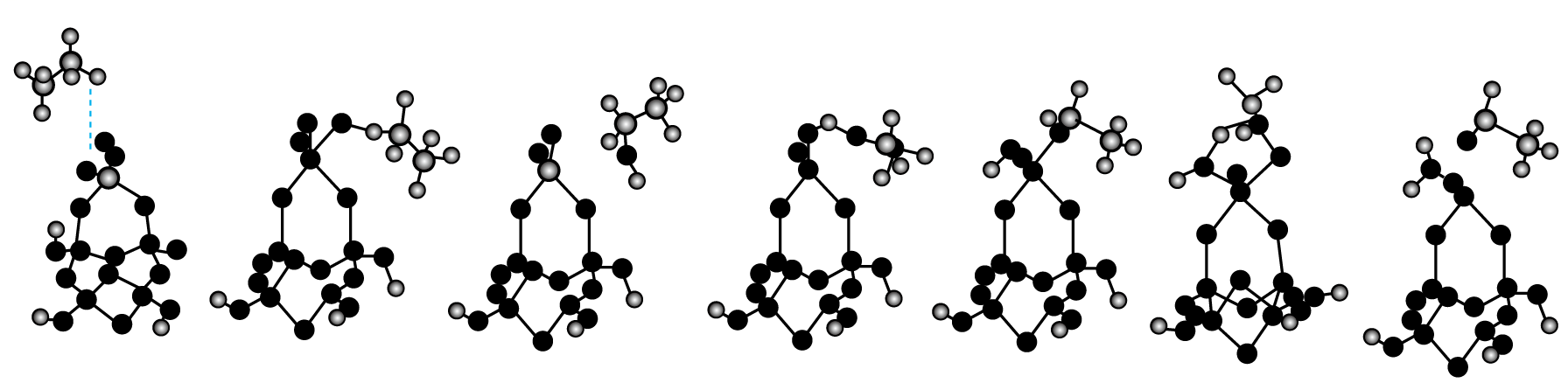
请回答下列问题:
化学键 | C-H | O-H | O=O | C=O | C-C |
键能kJ·mol-l | 413.4 | 426.8 | 497.3 | 750 | 347.7 |
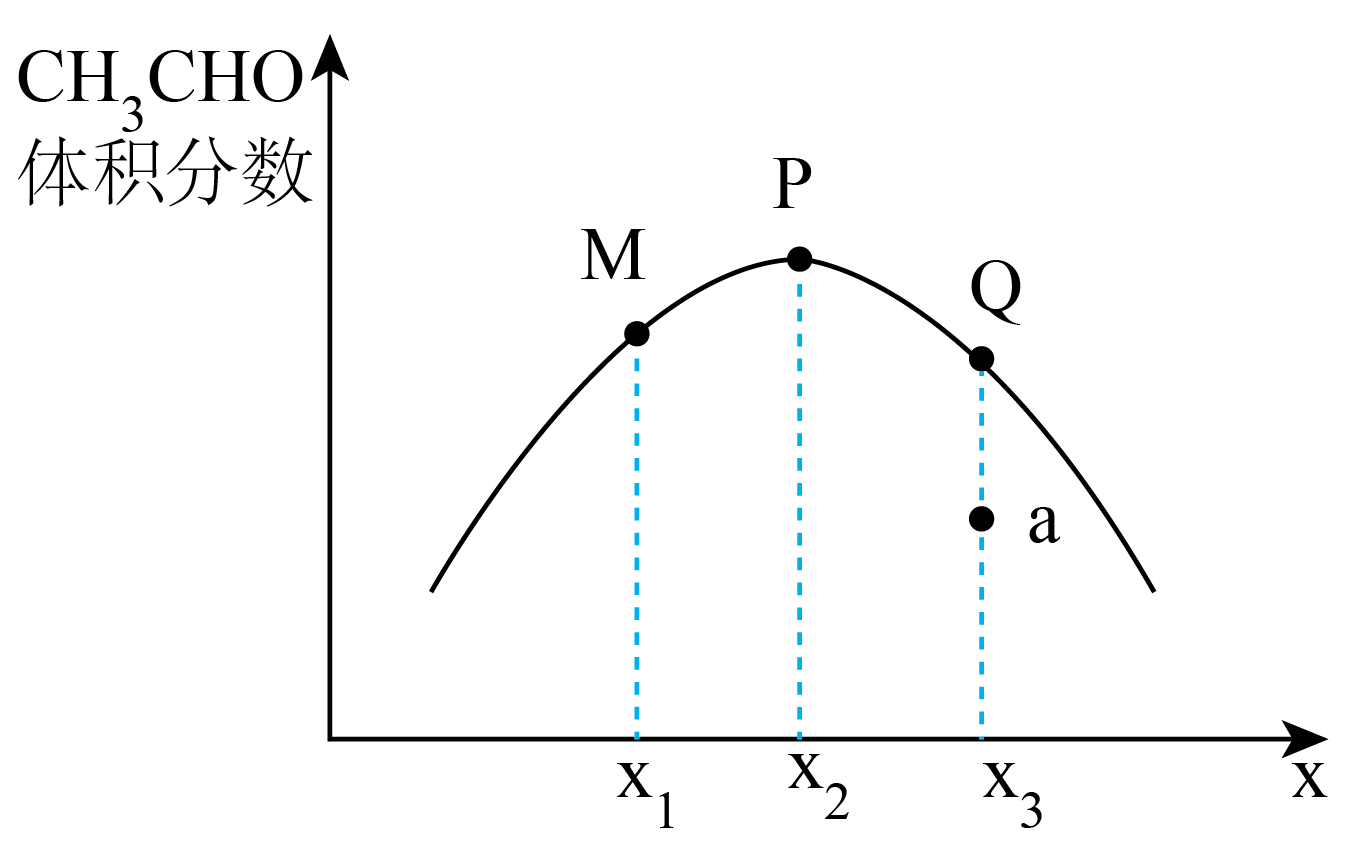
①反应。升高温度活化分子百分数将(填“增大”或“不变”或“减小”)。
②温度下,在
的刚性密闭容器中按一定比例
加入
和
发生反应,平衡时
的体积分数与
的关系如图所示。图中P点的横坐标
;乙烷转化率最大的是点(填“M”或“P”或“Q”);若要缩短a点至Q点所用的时间,可采取的措施有(答出一条即可)。