实验测得 ,
,
、
为速率常数,只与温度有关,T℃时,平衡时容器内
的物质的量为
, 则
与
的比值为(用含a的代数式表示);若将温度降低,速率常数减少的倍数:
(填“>”、“=”或“<”)
T℃时,将乙烷与氦气体积比混合后,通入一密闭容器中发生反应。平衡时容器压强为
, 若乙烷的平衡转化率为80%,反应的平衡常数
kPa(用分压表示,分压=总压×物质的量分数)。

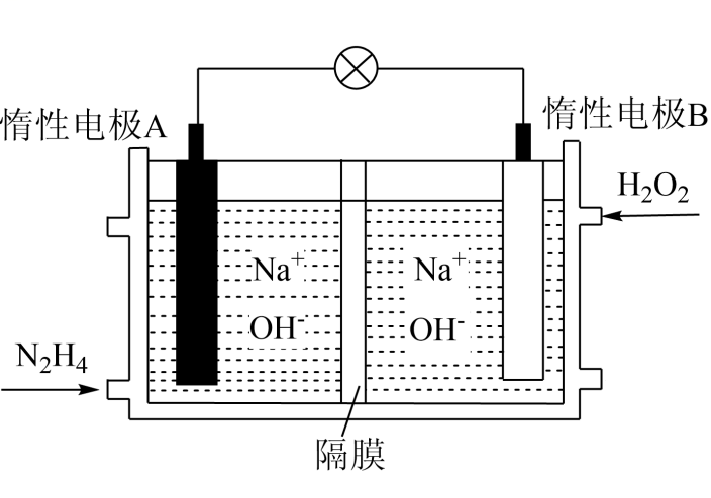
阴极电极反应式为。
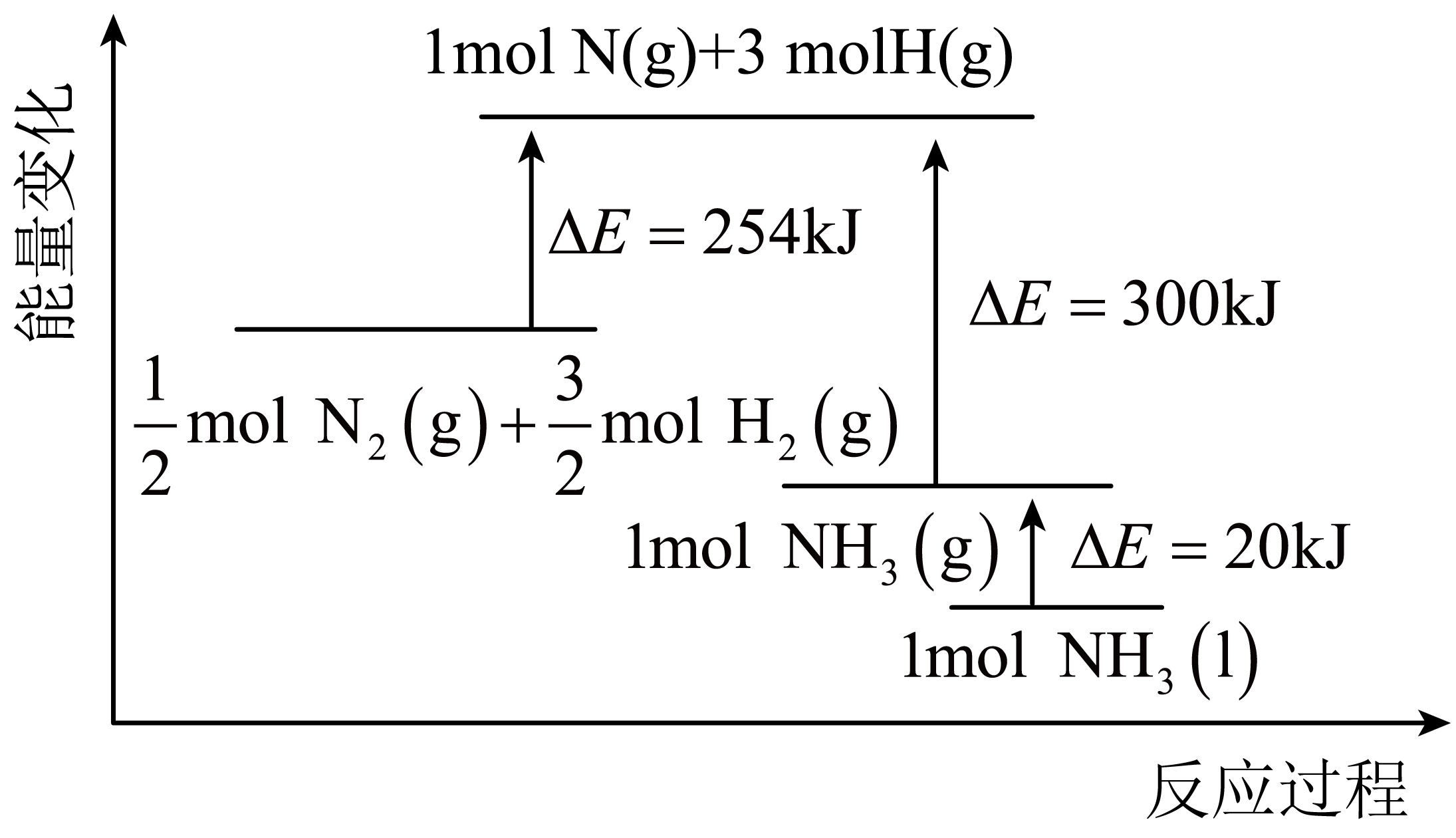

①A点的温度迅速从T1变为T2 , 则此时浓度商QK(T2)(填“>”“<”或“=”)。
②Kp(B):Kp(A)=(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
③合成氨逆反应速率方程为:v(逆)=k(逆) , 式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为。

①Pt−C3N4电极反应产生NH3的电极反应式。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因。
间接制取低碳烯烃:CO(g)+2H2(g)CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
回答下列问题:



已知:该反应![]() 焓变和熵变受温度影响很小,可视为常数。200℃时,该反应____自发进行。
焓变和熵变受温度影响很小,可视为常数。200℃时,该反应____自发进行。

①420℃时NO转化率低于390℃时NO转化率的原因可能是。
②B点(填“是”或“否”)达到化学平衡状态,理由是。
状态 | 热值(kJ/g) | 沸点(℃) | 密度(kg/L) | 液态能量密度(MJ/L) | |
氨气 | 气 | 18.6 | -33 | 0.6820 | 12.7 |
氢气 | 气 | 120 | -253 | 0.0708 | 8.5 |
氮元素燃烧后生成的稳定产物为N2。请书写NH3燃烧的热化学方程式。

①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。

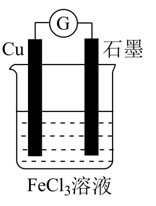
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。