①CO的平衡转化率a=;T1℃时,反应平衡常数k=(保留2位有效数字)。
②由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系如图1所示。若升高温度,反应重新达到平衡,则v正~x(CO)相应的点变为、v逆~x(H2)相应的点变为。



下列说法错误的是( )

已知:①“碱浸”时,GaAs中Ga以的形式进入溶液。
②离子完全沉淀时的pH:为8,
为5.6。

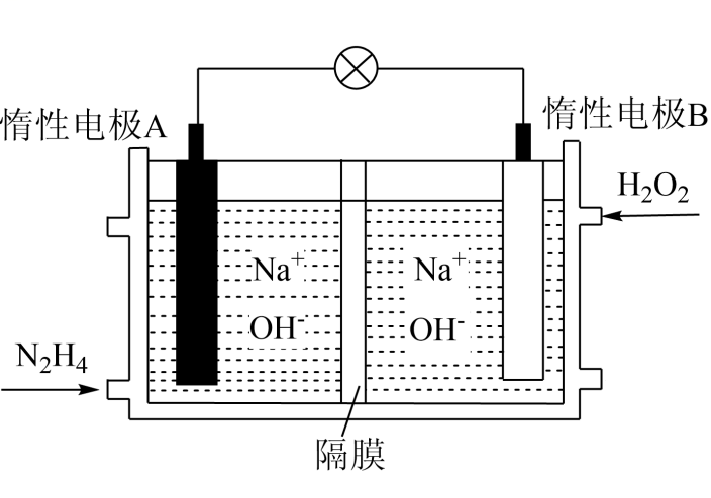
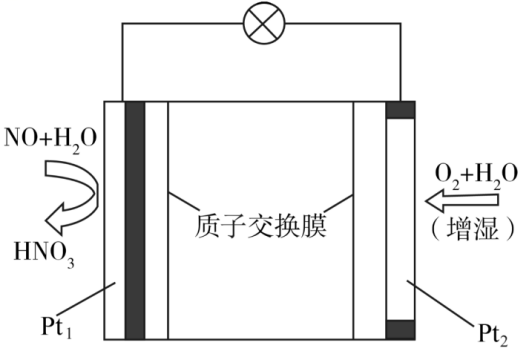
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。

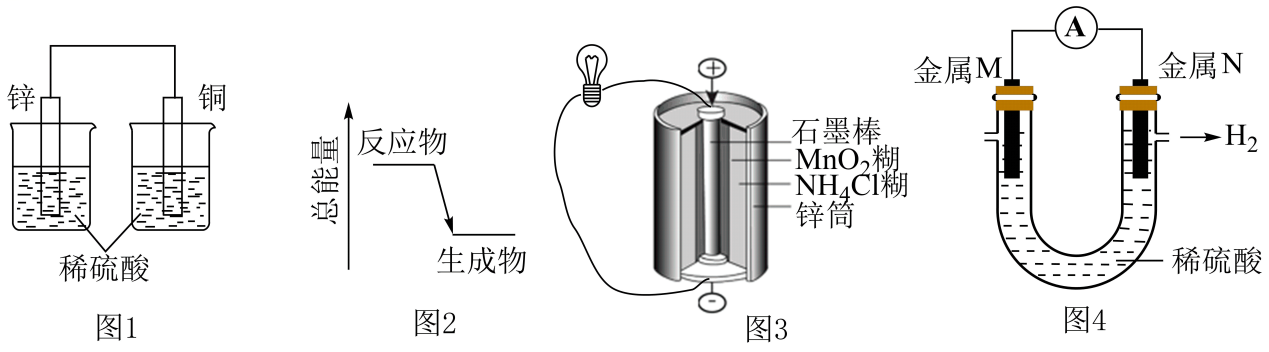
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。