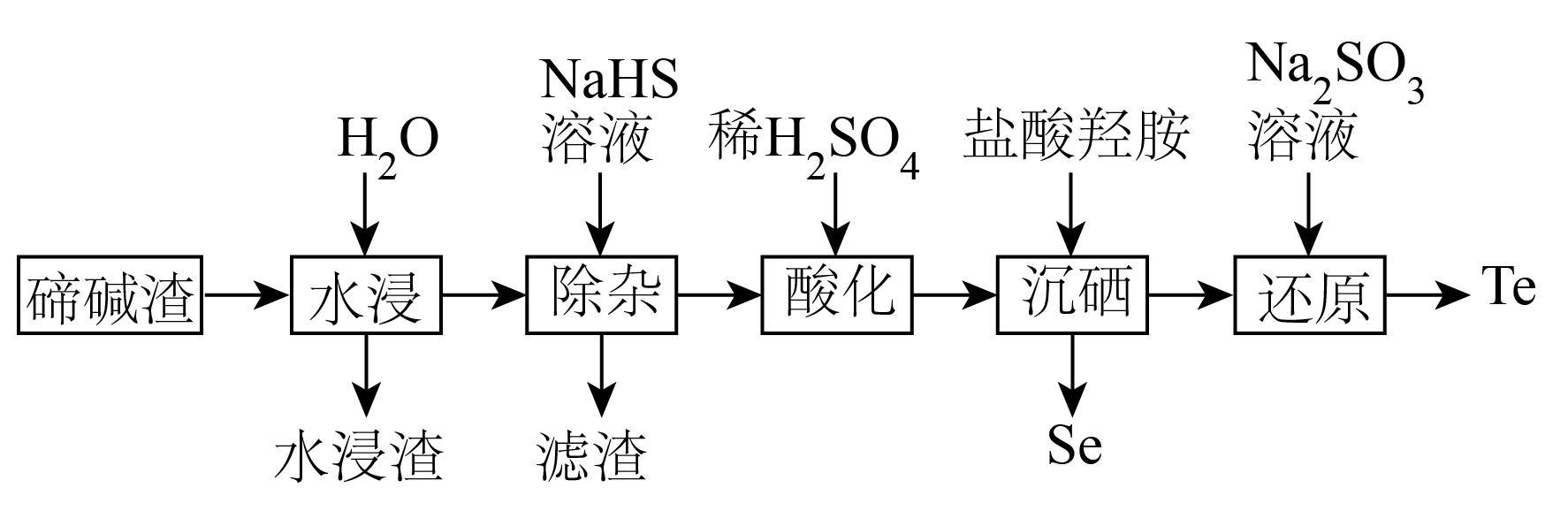
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
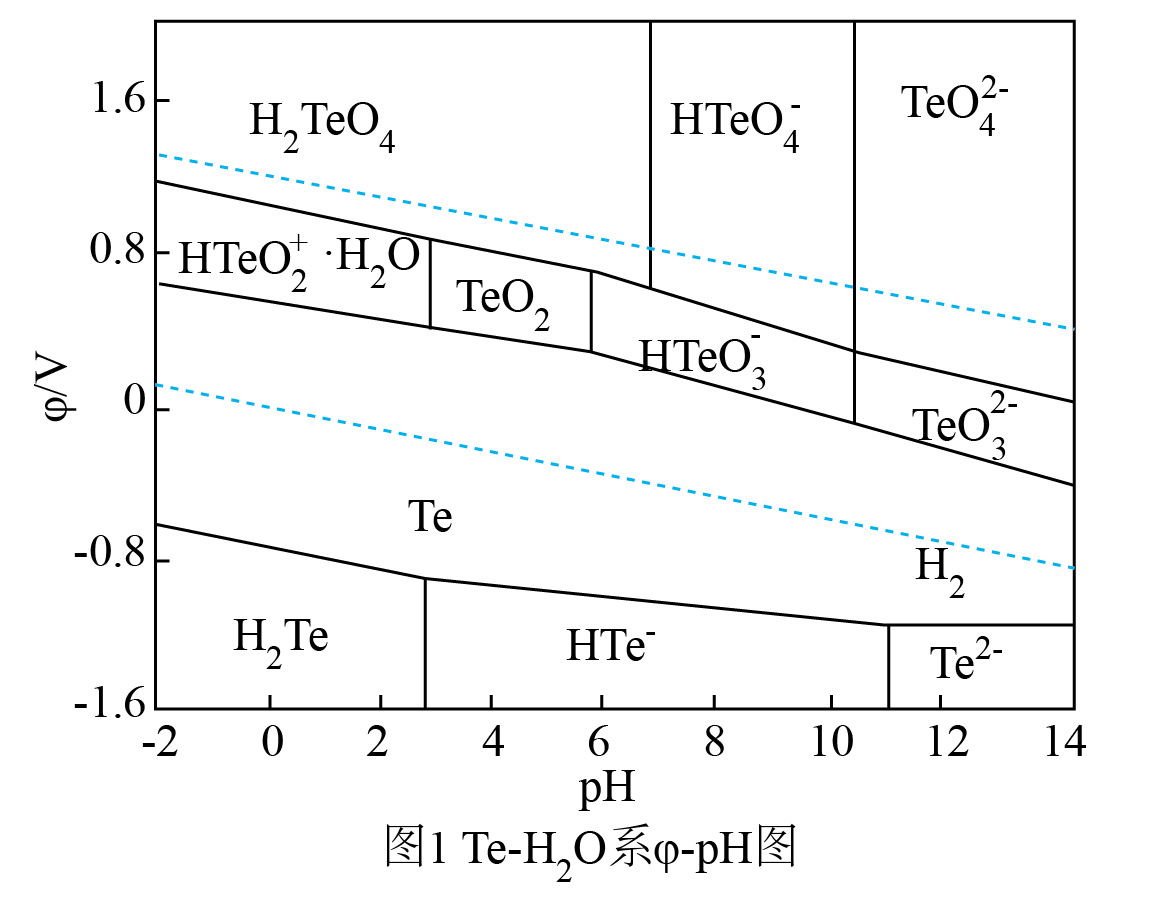
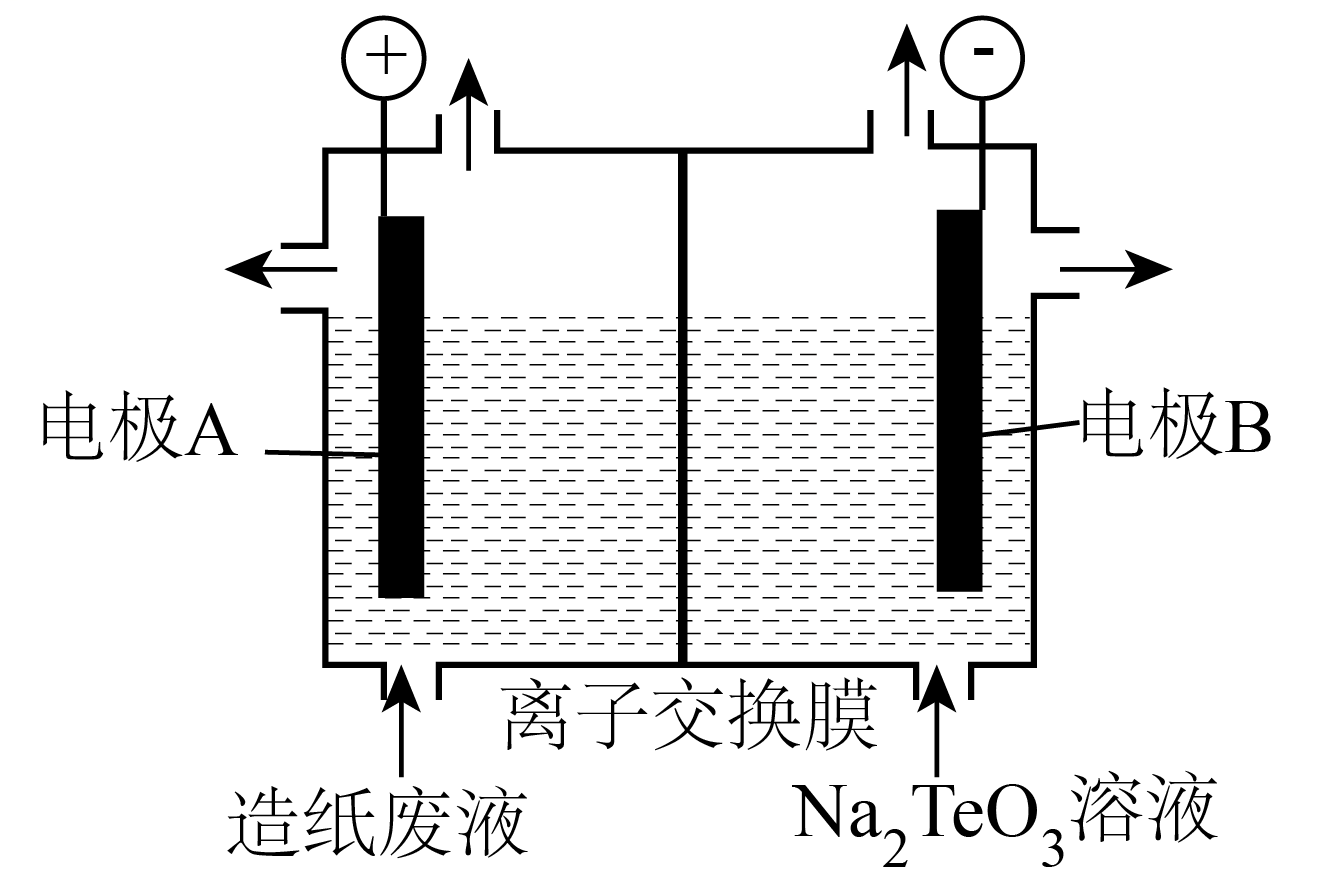
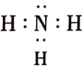 D .
D . 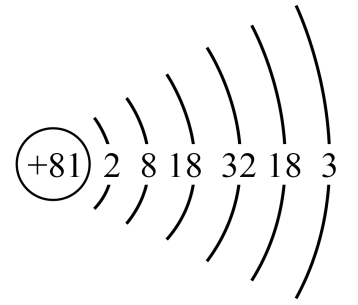 B . 基态铊原子的价层电子排布式:
B . 基态铊原子的价层电子排布式:已知。回答下列问题:
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键

元素 | |||
电离能/ | 717 | 759 | |
1509 | 1561 | ||
3248 | 2957 | ||
锰元素位于第四周期第族.比较两元素的
可知,气态
再失去1个电子比气态
再失去1个电子难,原因是.

A.  B.
B.  C.
C.  D.
D.
