
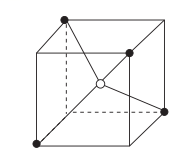
 B . SO2的VSEPR模型:
B . SO2的VSEPR模型: C . 基态24Cr原子的价层电子轨道表示式:
C . 基态24Cr原子的价层电子轨道表示式: D . Cl-Cl的p-pσ键模型:
D . Cl-Cl的p-pσ键模型:
 C . 氮原子的轨道表示式是
C . 氮原子的轨道表示式是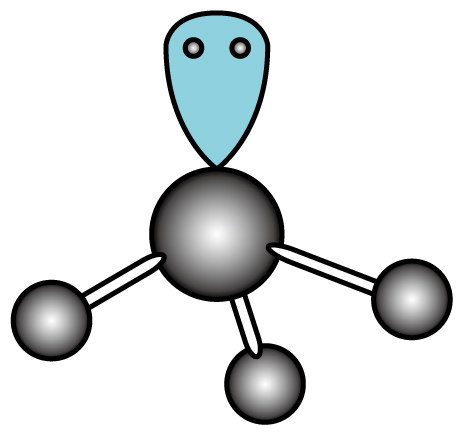 (三角锥形)
(三角锥形)
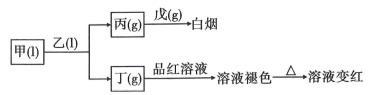
已知:乙、戊分子都含有10个电子,且两种分子中心原子的杂化方式均为杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
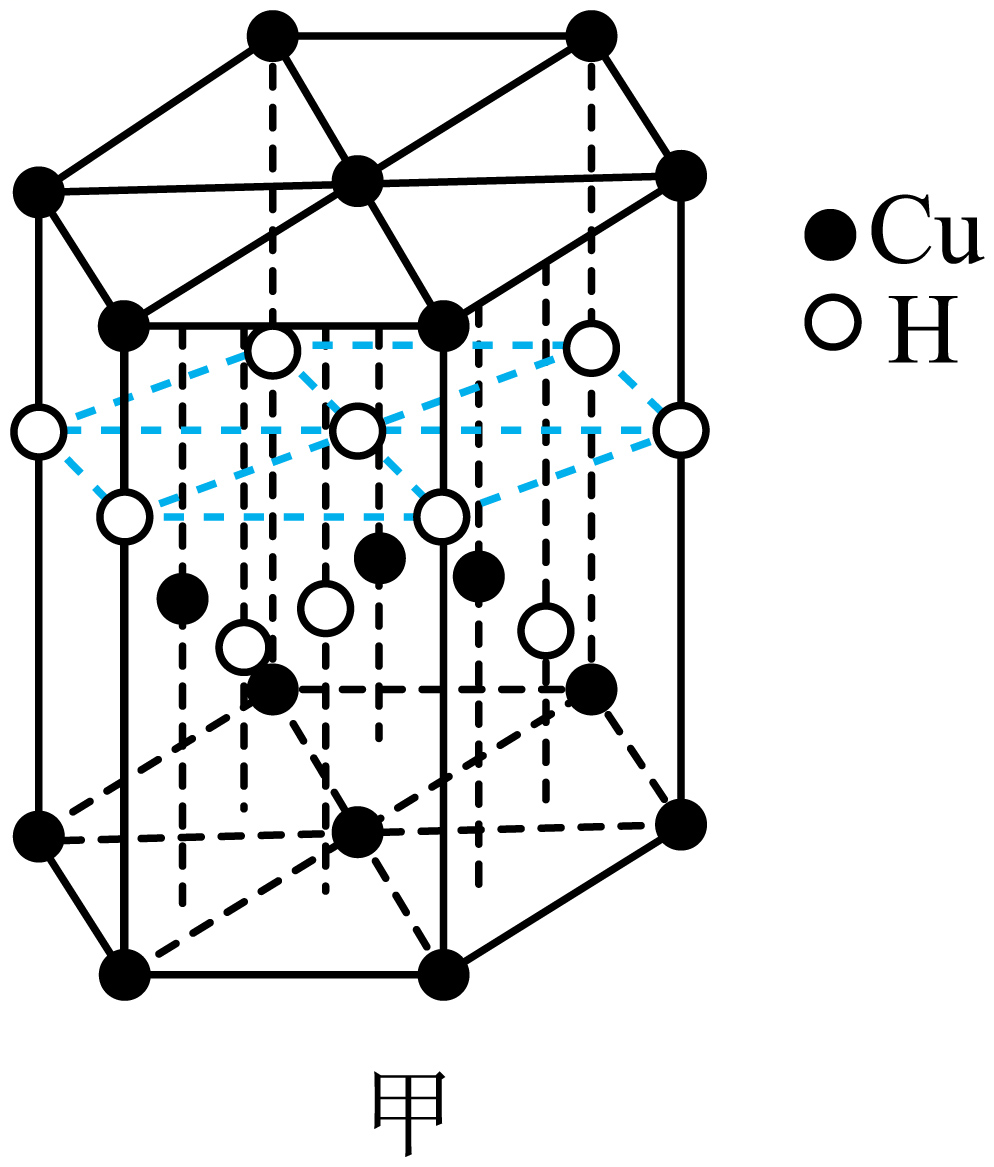

①基态铜原子的核外电子有种空间运动状态。与Cu元素同周期,基态原子有2个未成对电子的金属元素有种。
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填序号),第三电离能的变化图是(填序号)。
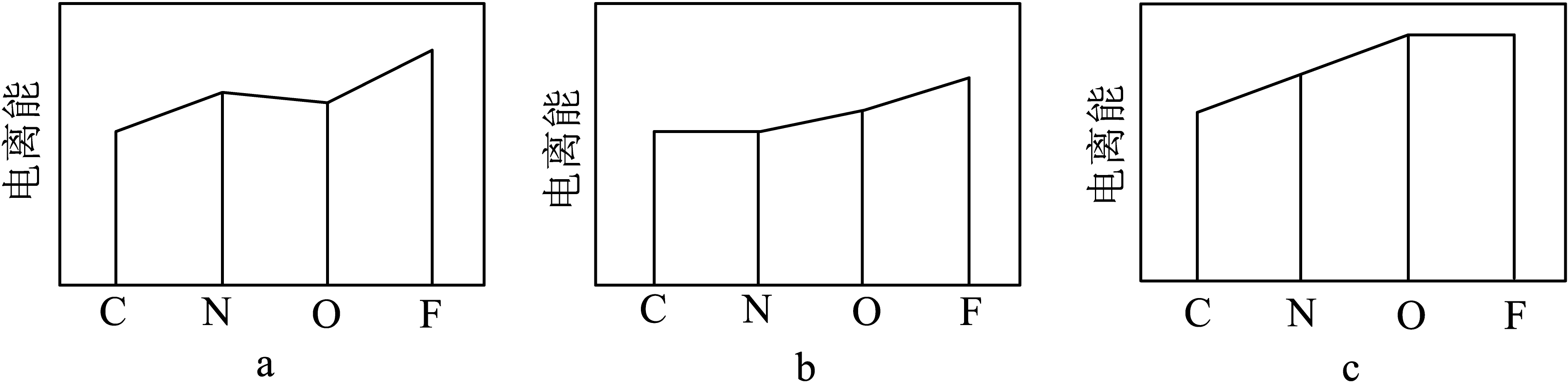
③化合物X中的中心铜离子的配位数是,图乙反应中断裂和生成的化学键有(填序号)。
a.离子键 b.键 c.极性键 d.氢键 e.配位键