①碱性锌锰电池的总反应为 ,
写出正极反应式.

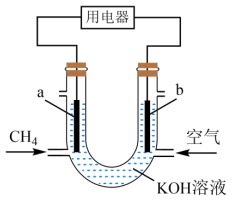
该电池负极的电极反应式为。


A | B | C | D |
|  |
|
|
NaCl溶于水 | 铜锌原电池工作 | 一种燃料电池工作 | 电解饱和食盐水 |
电离方程式: NaCl = Na+ + Cl- | 总反应: Zn + Cu2+ =Zn2+ + Cu | 负极反应: H2-2e-+ 2OH-= 2H2O | 总反应: 2Cl-+ 2H+ = Cl2↑ + H2↑ |

①通过减小容器体积增大压强 ②升高温度
③恒压条件通入He ④恒容条件下通入N2
①写出放电时负极的电极反应式:(注:PbSO4不溶于水)
②铅蓄电池放电时,负极质量将(填"增大""减小"或"不变")。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为。
① ②
③ ④

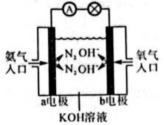
①能证明化学能转化为电能的实验现象是:电流表指针偏转、。
②从构成原电池的基本要素来看,的作用是(选填序号,下同),稀硫酸的作用是。
a.电极反应物 b.电极材料 c.离子导体 d.电子导体

a.通氢气的一极是正极,发生氧化反应
b.电子由电极经溶液流向
电极
c.总反应为
