 ):
):

金属离子 | ||||
开始沉淀时的pH | 6.8 | 2.2 | 7.5 | 9.4 |
沉淀完全时的pH | 9.2 | 3.2 | 9.0 | 12.4 |

温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 280℃ |
晶体形态 | 多种结晶水合物 |
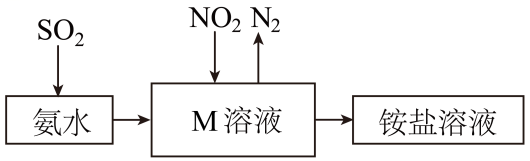
在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
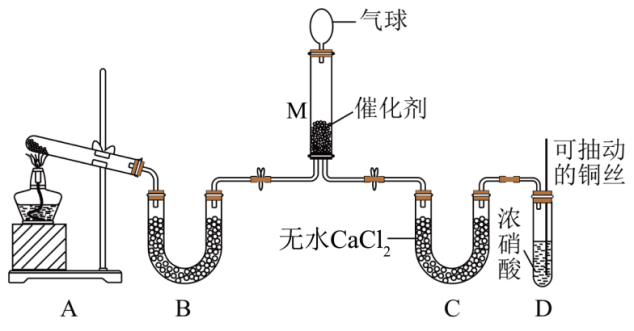
装置D中发生反应的离子方程式是
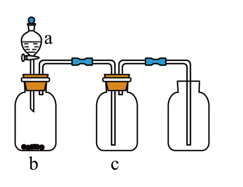
选项 | 气体 | a | b | c |
A | NO | 稀硝酸 | Cu | 浓硫酸 |
B | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | 浓氨水 | 生石灰 | 碱石灰 | |
D | 浓盐酸 | MnO2粉末 | 浓硫酸 |