已知:①“碱浸”时,GaAs中Ga以的形式进入溶液。
②离子完全沉淀时的pH:为8,
为5.6。

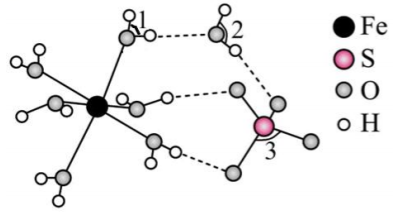
①深蓝色晶体化学式为。
②该实验条件下,与
的结合能力(填“>”、“=”或“<”)
与
的结合能力。
③H—N—H键角大小:(填“>”、“=”或“<”),其原因是。

图1 图2
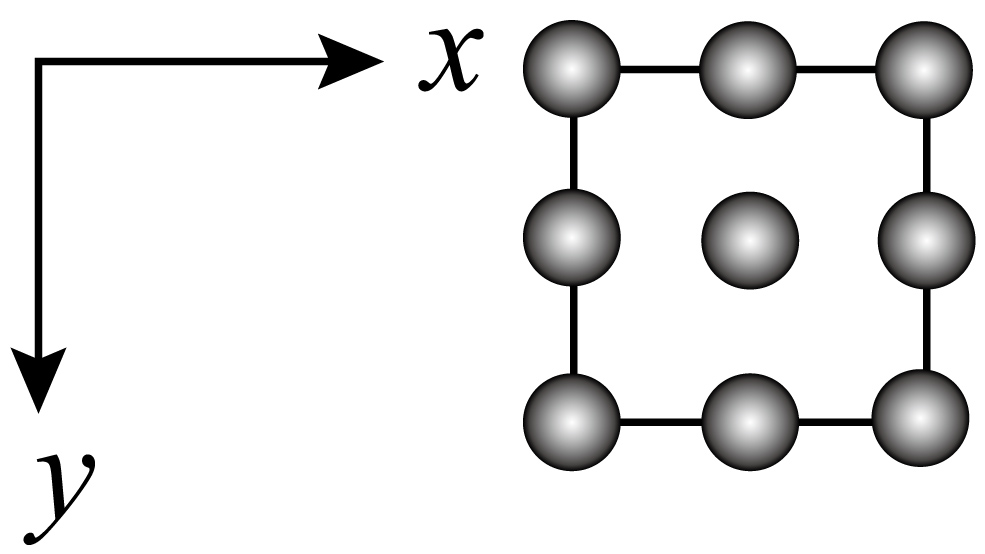
①CuS晶体中距离S最近的Cu数目为。
②CuS晶体的密度为(列出计算式即可)。
 图示
图示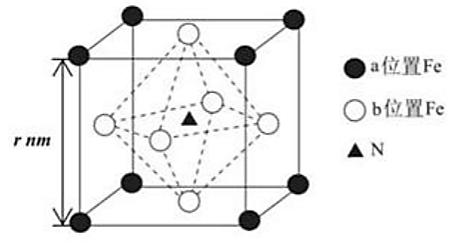


①化合物M的熔沸点明显低于化合物N,其主要原因是。
②化合物N中C原子的杂化类型为。
③C、N、O的第一电离能由小到大的顺序为。