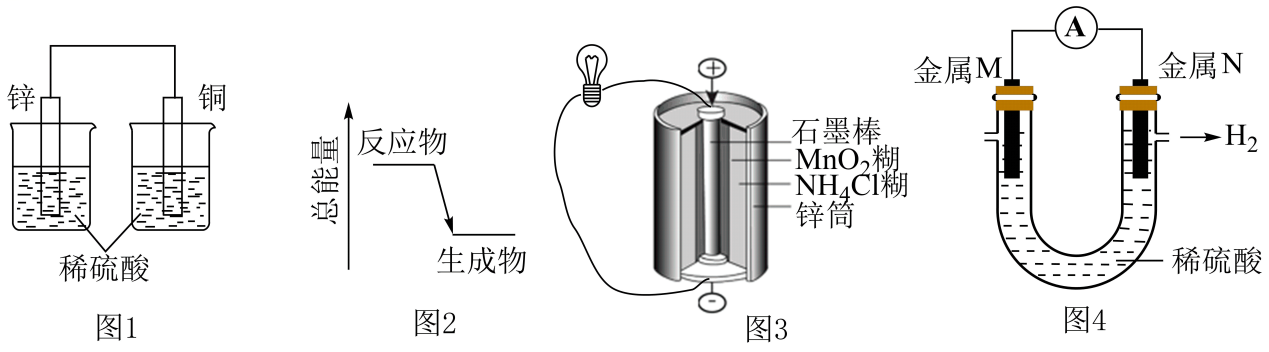
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。


(i) I2(?)+H2(g)2HI(g) (该反应完全发生,放热9.48kJ)
(ii) I2(?)+H2(g)2HI(g) (该反应完全发生,吸收26.48kJ)

回答下列问题:

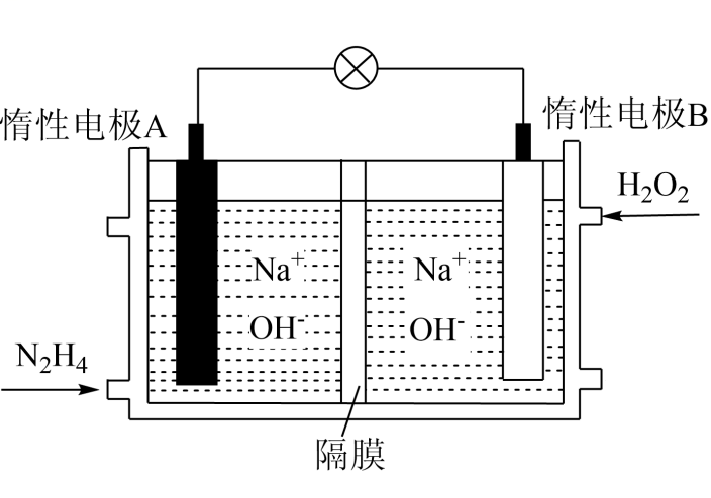
①A化学式为。
②电池正极的电极反应式为。
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
①甲基丙烯酸中杂化的碳原子与
杂化的碳原子的个数之比为,甲基丙烯酸钠中含有的化学键类型有。
②过渡元素离子与水形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为或
排布时,无颜色;为
时,有颜色,如
显粉红色。据此判断,
(填“有”或“无”)颜色。
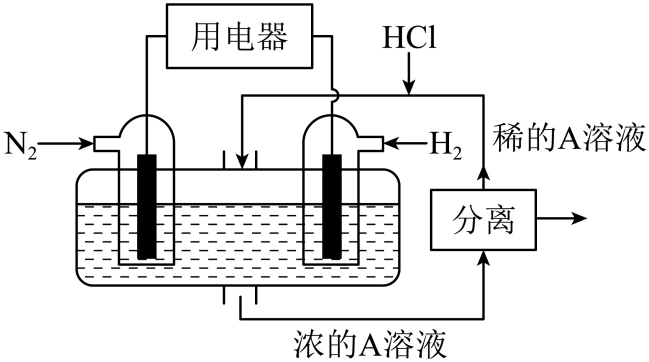
②。
则③中的
(用含
的式子表示),
(用含
的式子表示),该反应中每消耗
, 此时转移的电子数为
。
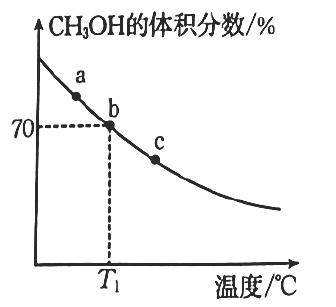
①下列有关反应的说法正确的是(填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大的平衡转化率
D.无论反应进行到何种程度,为某一定值
②平衡常数由大到小的顺序为。
③反应速率:(填“>”“<”或“=”)
。
④ , b点的平衡常数
。