化学键 | C=O | H—O | H—H | C—O | C—H | C—C |
键能( | 803 | 463 | 436 | 326 | 414 | 348 |
依据表中数据计算的
H=
, 下列有利于该反应自发进行的条件是(填标号)。
A.高温 B.低温 C.任何温度

该反应中形成的化学键有____(填标号)。
a. b.容器中气体的平均摩尔质量不变
c.CH3CH2OH的百分含量保持不变 d.容器中混合气体的密度保持不变

①表示的曲线为(填标号)。
②、
、
由大到小的顺序是。
③℃、投料比为
下,该反应的平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

①CO的平衡转化率a=;T1℃时,反应平衡常数k=(保留2位有效数字)。
②由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系如图1所示。若升高温度,反应重新达到平衡,则v正~x(CO)相应的点变为、v逆~x(H2)相应的点变为。



使用催化剂的曲线是(填“甲”或“乙”),该催化剂可使反应历程中决速步骤的活化能降低eV,平衡转化率(填“增大”“减小”或“不变”)。达到化学平衡后再升高温度,正反应速率(填“加快”或“减慢”),平衡(填“正向”“逆向”或“不”)移动。

已知:选择性是指生成目标产物所消耗的反应物的物质的量与参与反应的反应物的物质的量之比。图中表示平衡转化率的曲线是(填“a”“b”或“c”),其如图变化的原因是。
间接制取低碳烯烃:CO(g)+2H2(g)CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
回答下列问题:



①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。

化学键 | |||
能量/ | 436 | 391 | 946 |
工业合成氨反应中若完全反应,放出
热量。
①为了提高正反应的速率,下列措施可行的是
A.充入氦气 B.升高温度 C.使用催化剂 D.移除
②若恒容容器的体积为 ,
后
, 则此段时间内
;
③下列事实能够说明该反应达到化学平衡状态的是(填字母)
A.和
的物质的量之比为
B.混合气体的平均相对分子质量不再变化
C.
D.断开1个键同时形成2个
分子
实验编号 |
|
| 催化剂的比表面积( | |
1 | 280 | 82 | ||
2 | 280 | 124 | ||
3 | 350 | a | 82 |
请回答:①表中;
②此实验验证的影响因素除了催化剂的比表面积还有,
能证明该因素对反应速率的影响规律的实验编号为;
③已知催化剂不会改变反应的限度,请在右图中画出实验2从起始到时刻的
变化曲线。

则该反应自发进行的条件是:,。
A.恒温条件下,体系中混合气体密度不再随时间变化能说明反应达到平衡
B.绝热条件下,反应Ⅰ平衡常数K不再随时间变化而变化说明该反应达到平衡
C.其他条件不变,升高温度,能提高相同时间内处理的量
D.其他条件不变,提高碳氮比可能会提高平衡体系中
的物质的量分数
①该温度条件下反应Ⅰ平衡常数。
②随时间变化数据如下表,一定条件下反应时间t与
的转化关系如下图:

温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
1.00 | 0.70 | 0.50 | 0.20 | 0.20 | ||
1.00 | 0.60 | 0.36 | … | 0.30 |
依据上表数据分析,请在时间t与的转化关系图中标示
,
(假设
)条件下的变化曲线(要求有必要标注)
①
②
总反应的

①内,
,
的平衡转化率为%。
②该反应的平衡常数。

①铜电极上产生的电极反应式为。
②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4 , 此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为。
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
②。
则③中的
(用含
的式子表示),
(用含
的式子表示),该反应中每消耗
, 此时转移的电子数为
。
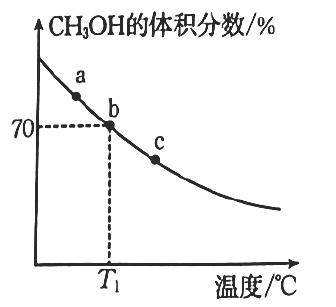
①下列有关反应的说法正确的是(填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大的平衡转化率
D.无论反应进行到何种程度,为某一定值
②平衡常数由大到小的顺序为。
③反应速率:(填“>”“<”或“=”)
。
④ , b点的平衡常数
。