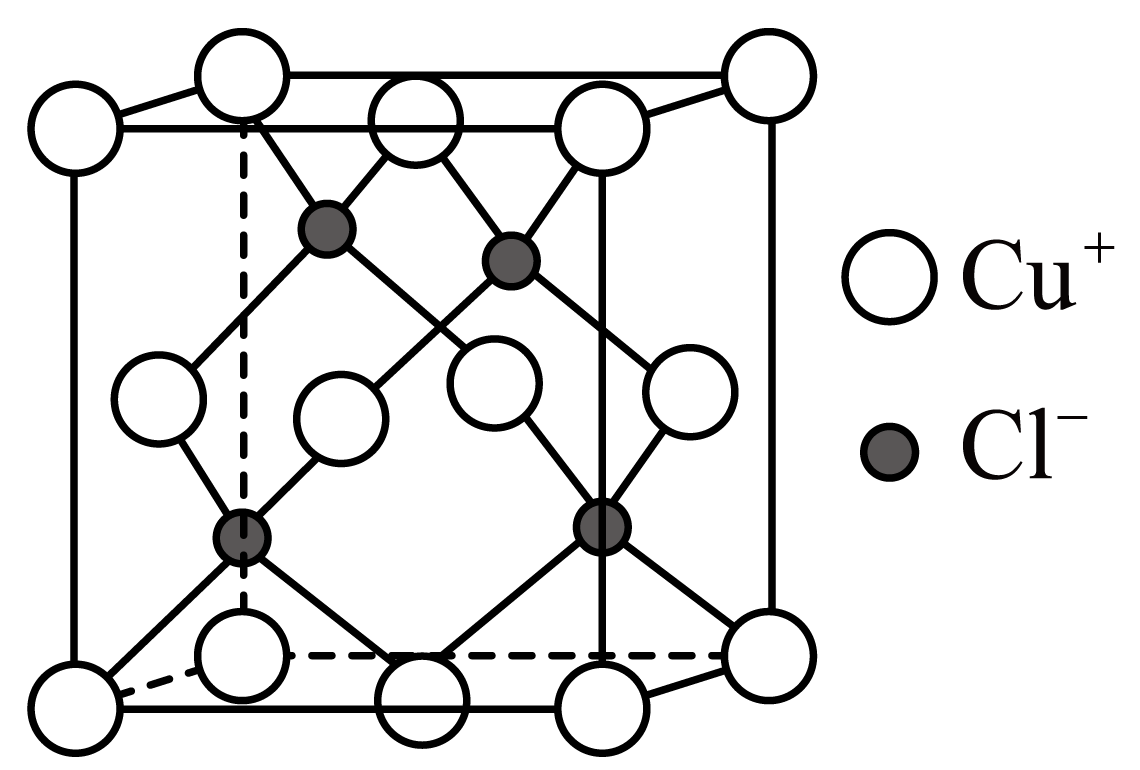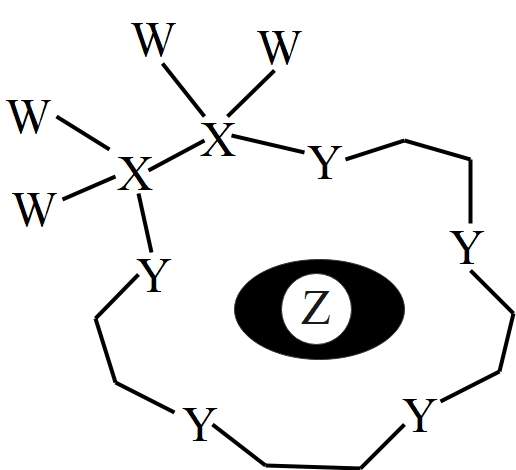
已知:①锗在硫酸中的存在形式:pH≤2.0时主要为 ,
时主要为
。
②常温下, ,
。
请回答下列问题:
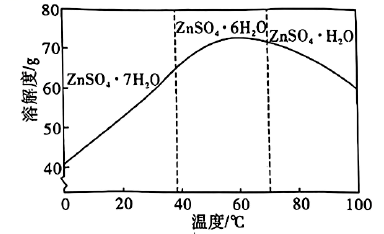
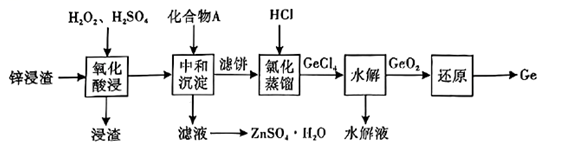
②用惰性电极电解溶液可制取金属锌,电解后的溶液可在上述流程中工序循环使用。
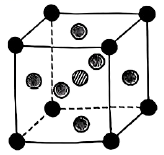
。(电负性:
)
下列说法正确的是。
A.原子半径:
B.GaAs为共价晶体,为分子晶体
C.沸点:
D.化学键中离子键成分的百分数:
②比较键角:
中的
中的
(填“>”“<”或“=”),请说明理由

如图所示晶胞沿着z轴的投影图为(填选项字母)。
A.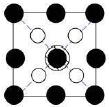 B.
B. C.
C.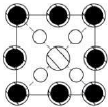 D.
D.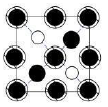
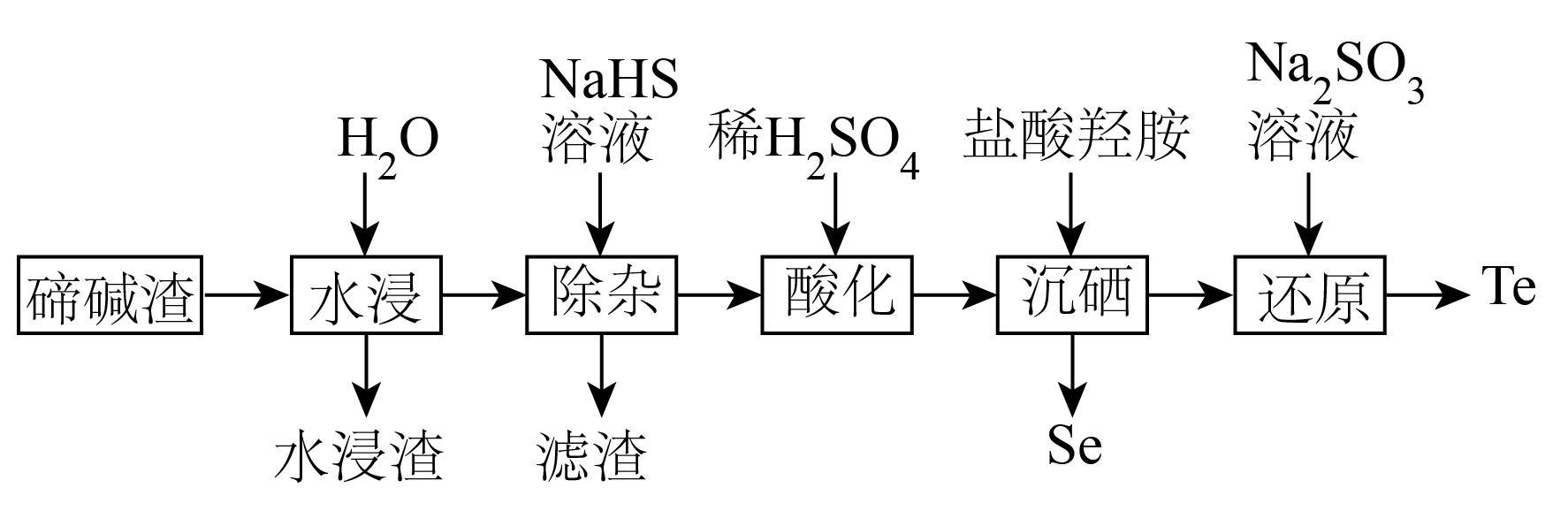
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
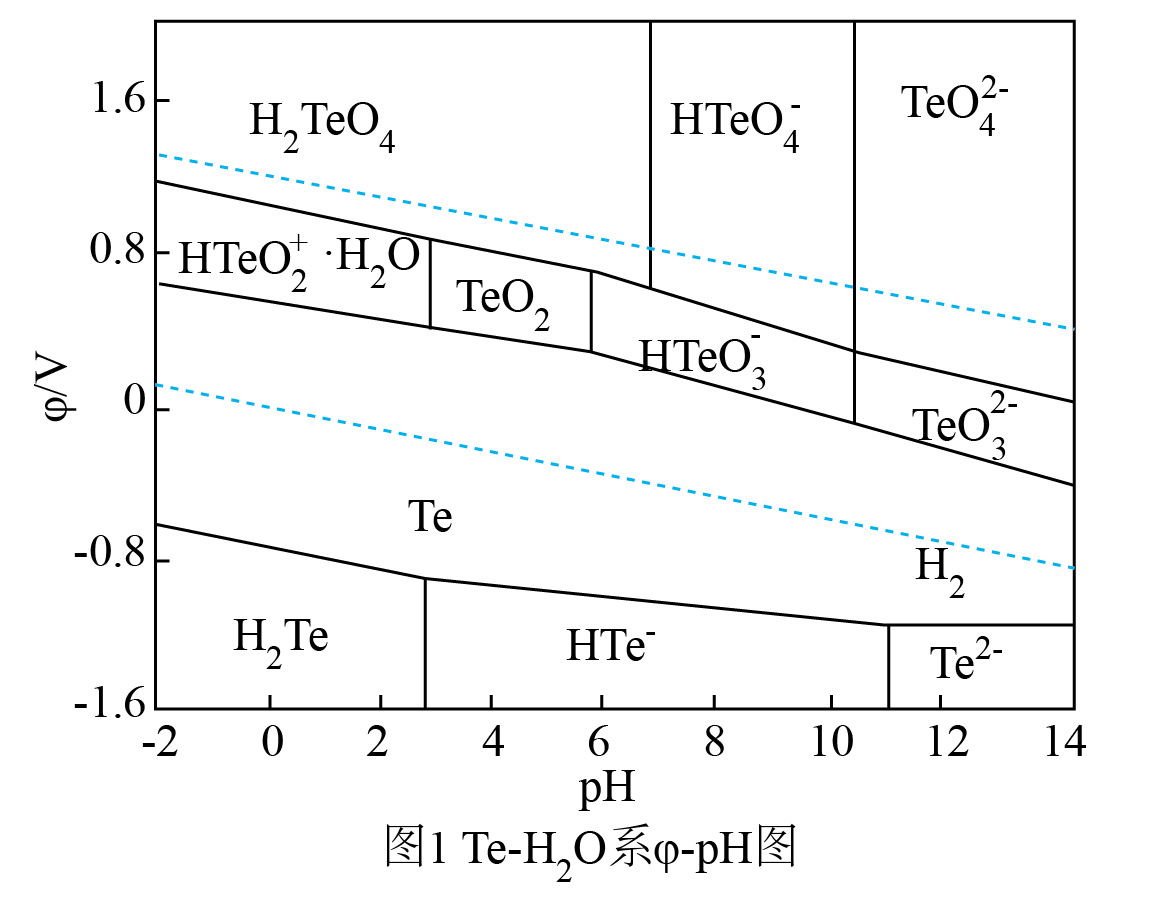
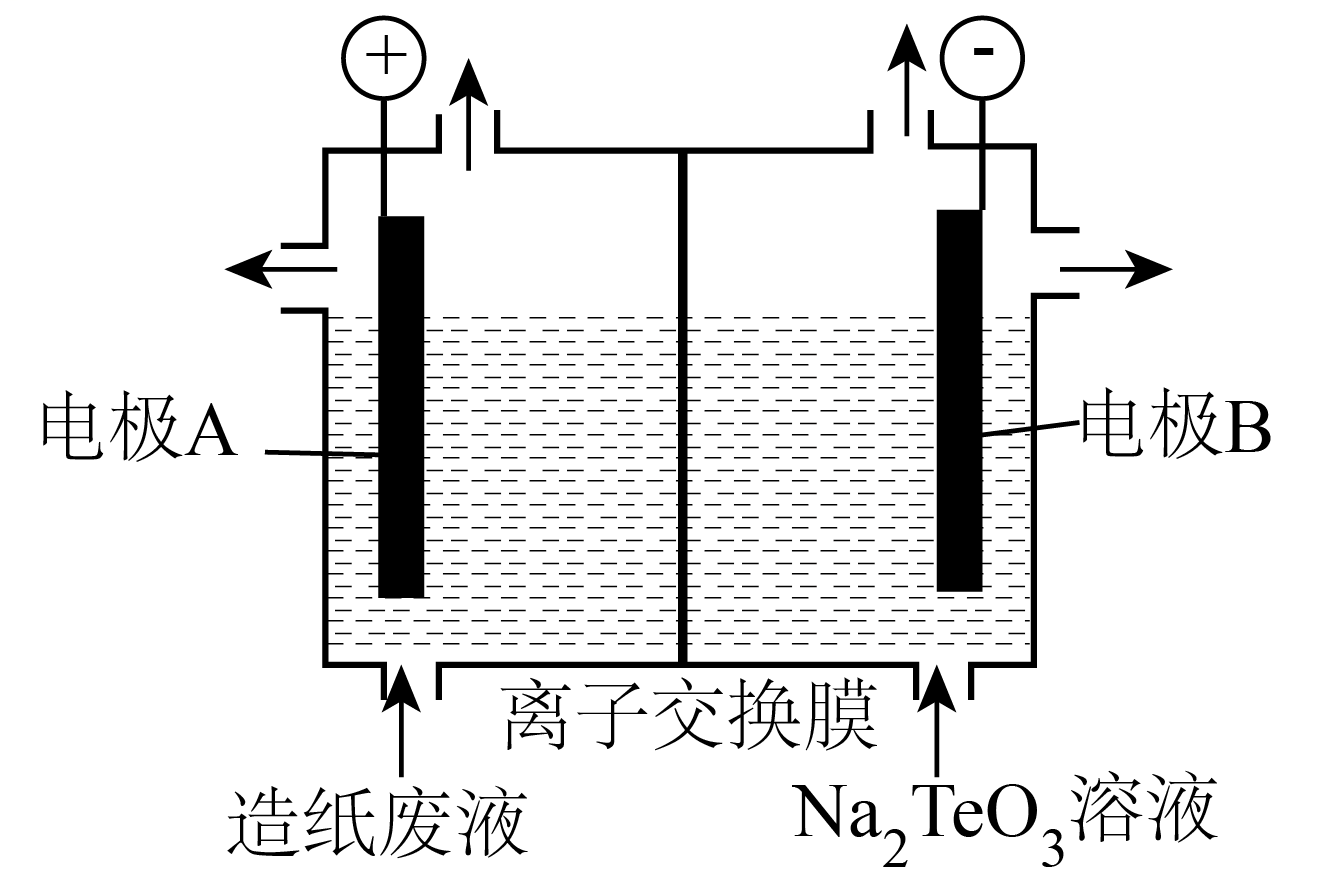

已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数
。