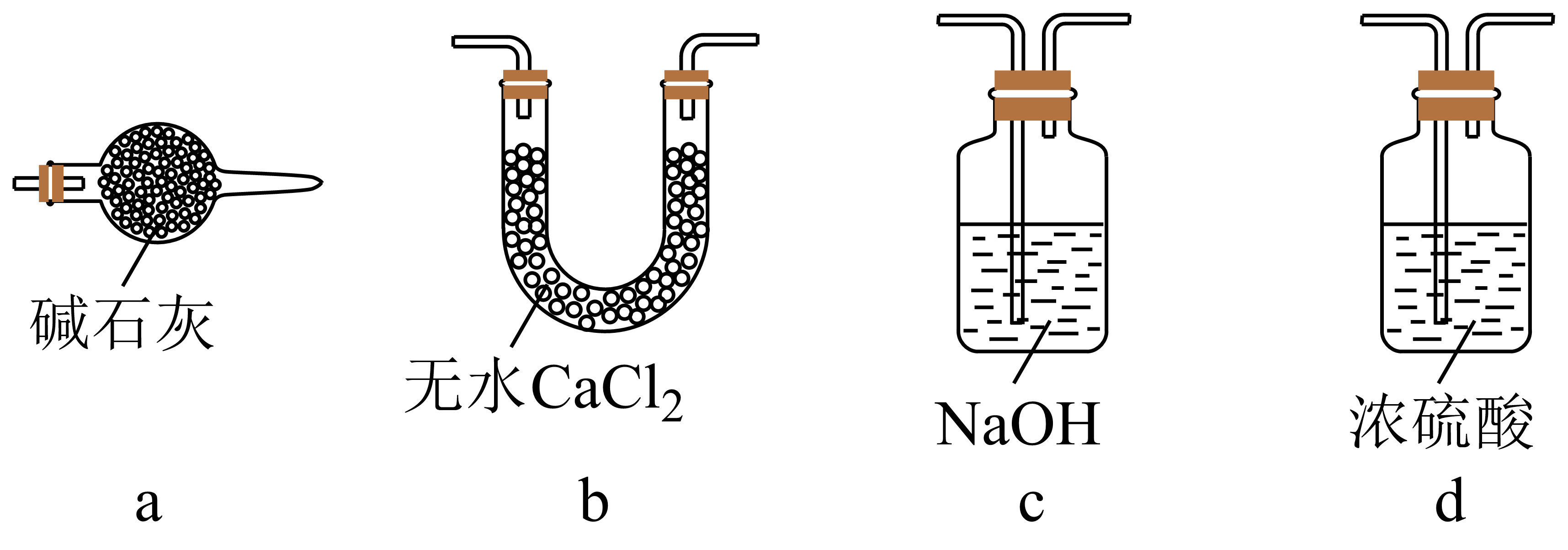
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:。
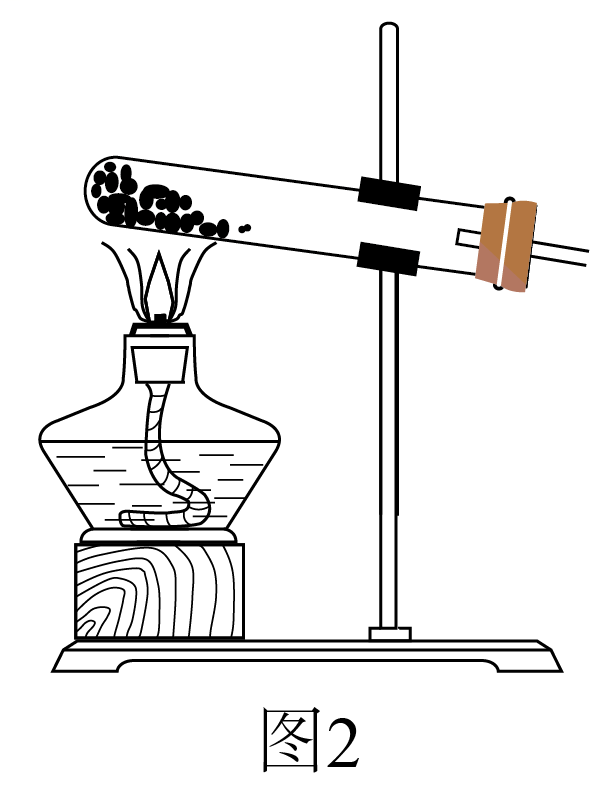
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
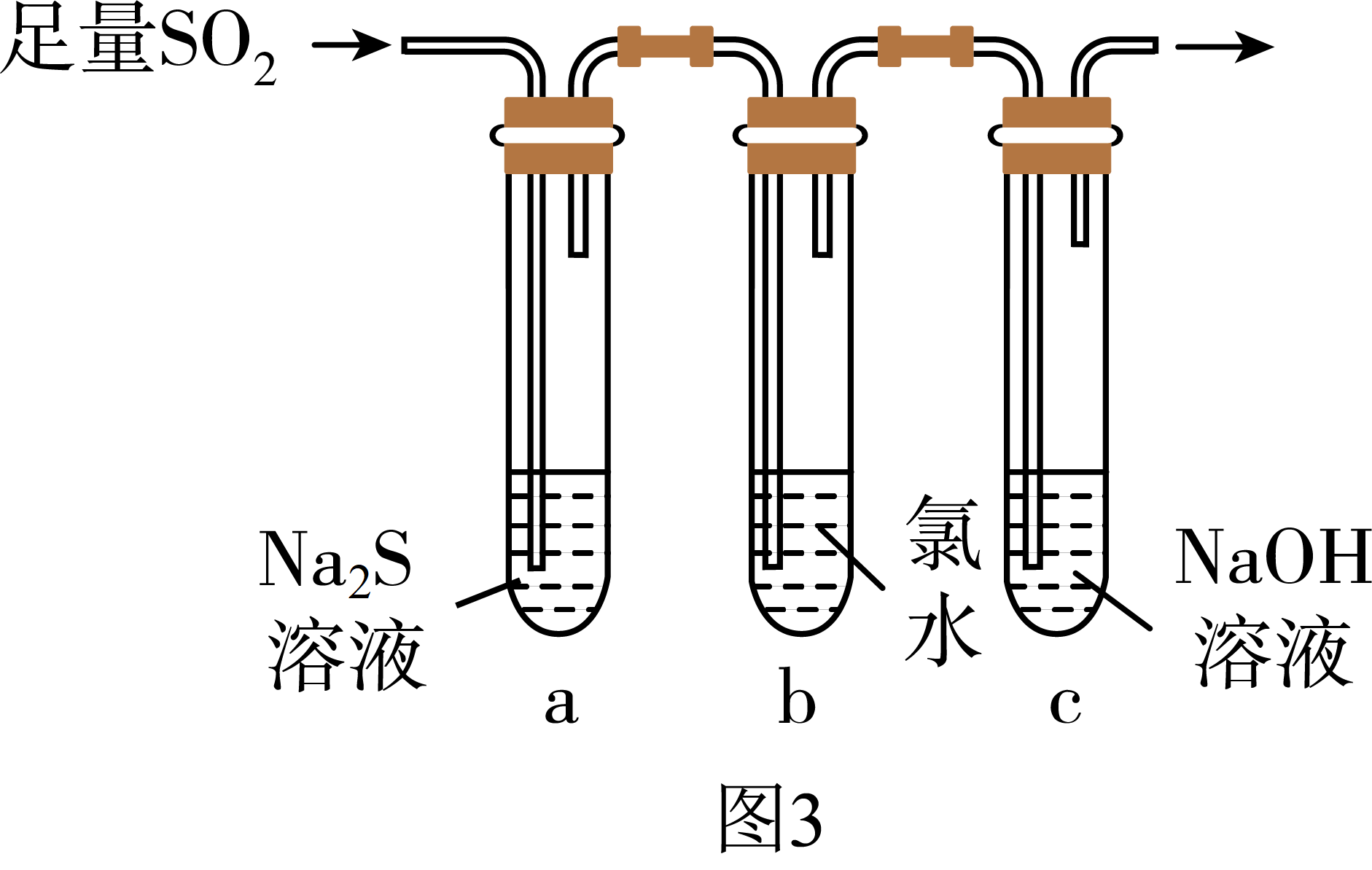
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去。
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”、或“Ⅲ”);
试管b发生反应的离子方程式:。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=用含硫微粒浓度的代数式表示)。
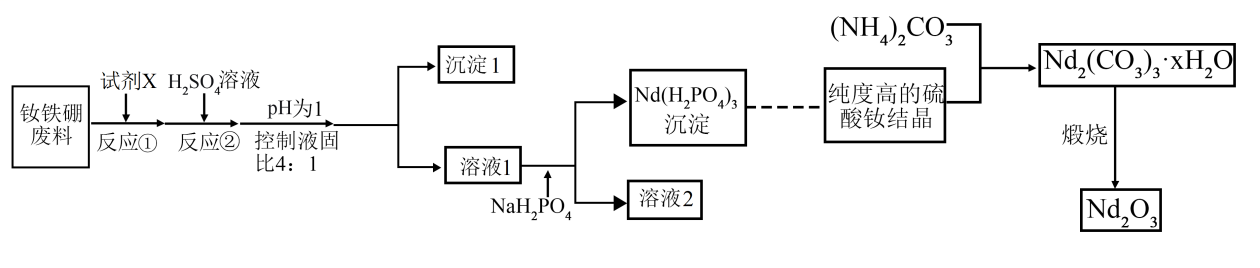
已知:①稳定的化合价为
;金属钕的活动性较强,能与酸发生置换反应。
②硼不与稀硫酸反应。
③常温下,。
回答下列问题:
①硼、氮、氧元素的第一电离能由大到小的顺序是。
②乙硼烷的结构式为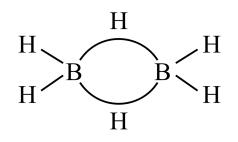 , 分子中B原子通过氢桥键(
, 分子中B原子通过氢桥键(![]() )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷分子中存在4个氢桥键且有两个五元环,写出其结构式。
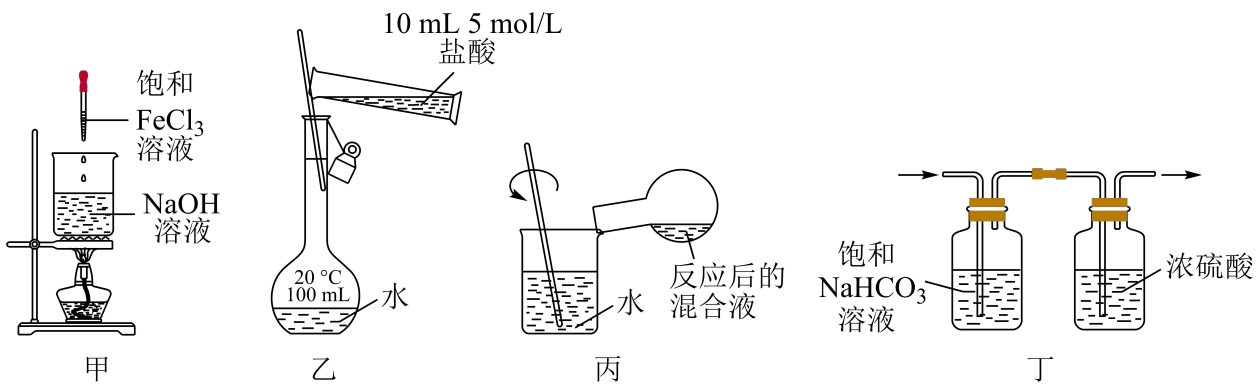
| 实验操作及现象 | 实验结论 |
A | 某溶液中先加入 沉淀不消失 | 该溶液不一定有 |
B | 向饱和 | 氯水中含 |
C | 向饱和 | 溶解度: |
D | 把绿豆大的 | 金属性: |
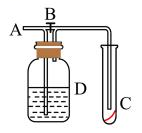

已知:SO2Cl2熔点为-54.1℃,沸点为69.1℃,遇水迅速反应生成两种强酸,且高温条件下不稳定。
回答下列问题:
a.氯酸钾 b.二氧化锰 c.浓硝酸 d.漂白粉