已知:钒的氧化物在酸性条件下以、
存在,
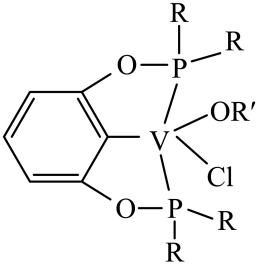
增大时
可转化为
沉淀。
①硫酸的用量会影响钒的浸出率,需保持在1.2以下的原因是。
②过程中除了有被还原成
, 还涉及的反应离子方程式为。
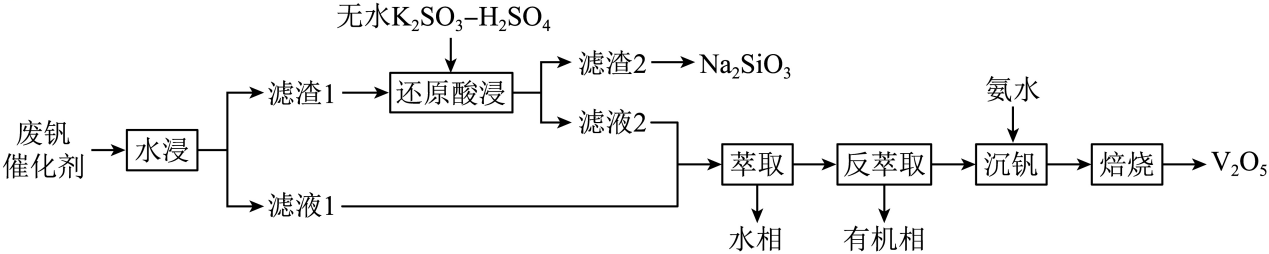
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供(选填“孤对电子”或“空轨道”)。
I.样品分解:称取a g毒重石矿粉于烧杯中,加入稍过量的溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
II.除:向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
III.结晶:将步骤II的滤液经过①,②,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
回答下列问题:

某学生查阅资料: , X代表
,
、
等,
代表
的阴离子,设计如下纯度测量方案:
步骤I.准确称取粗品并用20.0mL水溶解。
步骤II.用的
标准溶液滴定其中的
步骤III.重复滴定2~3次,记录每次消耗标准溶液的体积
①滴定时采用下图所示的侧边自动定零位滴定管,结合该装置的使用说明书分析其优点。

②下列选项所涉及内容会导致含量的测定值偏高的是(填序号)。
a.未干燥锥形瓶 b.标准溶液久置部分失效
c.滴定终点时滴定管尖嘴中产生气泡 d.杂质可与反应

已知:①微溶于水。
难溶于水,且能与过量的
生成
。
②常温下,几种物质的。如下表:
物质 | ||||
回答下列问题:

已知:①甲醇沸点61.7℃。
②六水合三氯化铬易溶于水、可溶于乙醇、不溶于乙醚。
③的性质与
类似。

回答下列问题:
第1次 | 第2次 | 第3次 |
20.05mL | 20.30mL | 19.95mL |
①“继续加热煮沸一段时间”的目的是。
②滴定终点的现象为。
③该产品的纯度为%(结果保留1位小数)。
化学键 | ||||
键能/( | 348 | 615 | 413 | 436 |


①表示的曲线为(填“M”或“N”)。
②a点反应的平衡常数kPa(列出计算式,分压=总压×物质的量分数)。


已知:①几种物质的部分性质如表所示。
物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
乙酸乙酯 | 77.2 | 88 | 微溶 |
乙酰乙酸乙酯 | 181(温度超过95℃,易分解) | 130 | 微溶 |
乙酸 | 118 | 60 | 易溶 |
②10乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇。③
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
回答下列问题:


已知:可溶于水
和
都是酸性氧化物。
以石墨为阳极,“电解”时阴极的电极反应式为,阳极产生的气体是(填化学式)。
|
|
|
|
A.实验室保存液溴 | B.验证二氧化硫的漂白性 | C.验证苯环对羟基的活化作用 | D.验证醛基的还原性 |
实验目的 | 实验方法或操作 | |
A. |
| 向 |
B. | 检验 | 取样,加入适量酸性高锰酸钾溶液后观察是否褪色 |
C. | 比较 | 常温,测浓度均为 |
D. | 比较Mg和Al的金属性强弱 | 向浓度均为 |
选项 | 实验操作 | 现象 | 结论 |
A | 向溴水中加入苯,振荡后静置 | 分层,水层颜色变浅 |
|
B | 溴乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中 | 溶液紫红色褪去 | 反应有乙烯生成 |
C | 向试管中加入1mL10%蔗糖溶液,再加入过量10% | 没有砖红色沉淀产生 | 蔗糖不属于还原糖 |
D | 向盛有2mL0.1mol/LNaCl溶液的试管中滴加2滴 | 先出现白色沉淀,后出现黄色沉淀 | 相同温度下 |