
①写出水解反应的离子方程式:,往其溶液中加入下列物质,能促进
水解的是 (填字母)。
A. B.
C.
D.
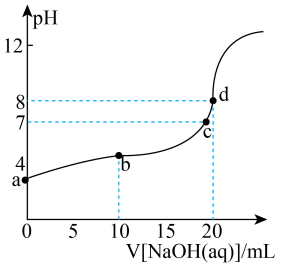
②常温下,向溶液中滴入
的
溶液,溶液的
变化曲线如图所示,d点溶液中
(保留两位有效数字);b点溶液中:
(填“>”“<”或“=”)
。
①常温下要使降低为
, 溶液的
应调至。
②向硫酸铜溶液中通入
气体,该反应的离子方程式为,当溶液中的
时,
。

①若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会(填“增大”“不变”或“减小”)。
②若c点溶液中溶质的总物质的量为 , 向c点溶液中加入
的
, 此时溶液满足的元素质量守恒式为。
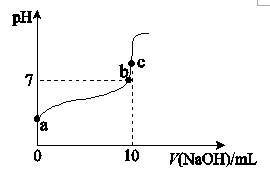
①c(Na+) =c(CH3COO−)的点是.(填“a”、“b”或“c”,下同)。
②水的电离程度最大的点是 。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 (Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
①CH3COOH的电离平衡常数表达式Ka=。
②比较等物质的量浓度溶液的pH:pH(NaClO) pH(CH3COONa) (填“>”、“<”或“=”)。
③预测下列化学反应能够发生的是。
A.HClO + CH3COONa = CH3COOH + NaClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.2CH3COOH + Na2CO3 = 2CH3COONa + H2O+CO2