反应②
则CO2催化加氢直接合成二甲醚反应③kJ·mol-1 , 该反应的活化能:Ea(正)(填“>”或“<”)Ea(逆)

①图中,温度高于290℃时,CO2平衡总转化率随温度升高而增大的原因可能是。
②T℃下,在2L恒容容器中投入1molCO2和3molH2 , 10min达到平衡时,CO2的总转化率为40%,此时CH3OCH3的选择性(已知)为50%。0~10min内
mol·L-1·min-1;T℃时,反应③的平衡常数K=(写出数字表达式即可)。

①二甲醚从(填“a”或“b”)口通入,写出M极的电极反应式:。
②当消耗13.44L(标准状况下)O2时,消耗的二甲醚的物质的量为mol。
已知:①
②


实验测得 ,
,
、
为速率常数,只与温度有关,T℃时,平衡时容器内
的物质的量为
, 则
与
的比值为(用含a的代数式表示);若将温度降低,速率常数减少的倍数:
(填“>”、“=”或“<”)
T℃时,将乙烷与氦气体积比混合后,通入一密闭容器中发生反应。平衡时容器压强为
, 若乙烷的平衡转化率为80%,反应的平衡常数
kPa(用分压表示,分压=总压×物质的量分数)。

阴极电极反应式为。
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。

①
②
总反应的

①内,
,
的平衡转化率为%。
②该反应的平衡常数。

①铜电极上产生的电极反应式为。
②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4 , 此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为。
反应A:4HCl+O22Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
参加反应的物质及状态 | |||
1mol分子中的化学键断裂时需要吸收的能量 | 436 | a | 369 |
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1 , 蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:。
①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:。
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
②。
则③中的
(用含
的式子表示),
(用含
的式子表示),该反应中每消耗
, 此时转移的电子数为
。
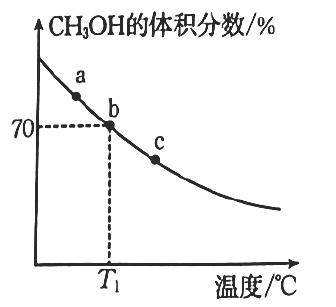
①下列有关反应的说法正确的是(填标号)。
A.该反应的反应物的键能总和小于生成物的键能总和
B.当混合气体的密度不再随时间改变时,该反应达到平衡
C.升高温度,有利于增大的平衡转化率
D.无论反应进行到何种程度,为某一定值
②平衡常数由大到小的顺序为。
③反应速率:(填“>”“<”或“=”)
。
④ , b点的平衡常数
。
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
① 0-5 min内,以N2表示该反应速率v(N2)= mol·L-1·min-1 , 第15 min后,将温度调整为T2 , 数据变化如上表所示,则T1 T2(填“>、< 或 =”)。
② 若为绝热恒容容器,下列表示该反应已达到平衡状态的是(填字母)。
A.混合气体的密度不再变化 B.温度不再变化
C.NO和的消耗速率之比为1:2 D.混合气体中c(NO) = c(N2)

图中a、b、c三点,达到平衡的点是。
ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。