①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。

Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。
①
②
③
该反应在(填“高温”或“低温”)条件下能自发进行。

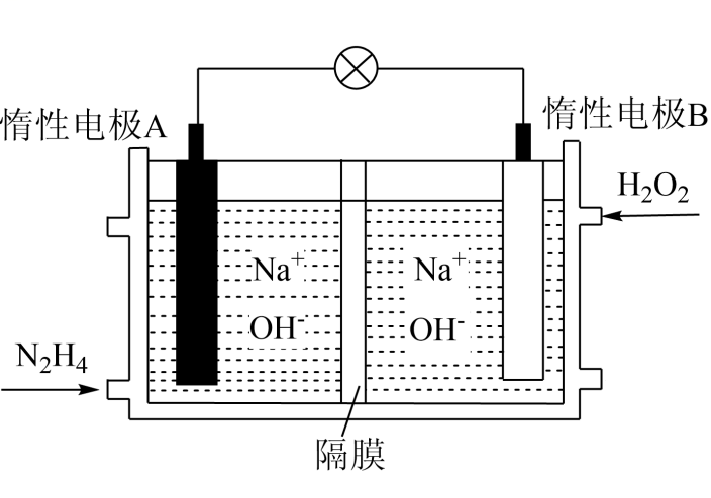
装置中气体A为(填“”或“
和
”),a极上的电极反应式为。

(i) I2(?)+H2(g)2HI(g) (该反应完全发生,放热9.48kJ)
(ii) I2(?)+H2(g)2HI(g) (该反应完全发生,吸收26.48kJ)
①
②
总反应的

①内,
,
的平衡转化率为%。
②该反应的平衡常数。

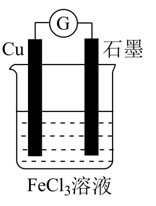
①铜电极上产生的电极反应式为。
②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4 , 此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为。
反应A:4HCl+O22Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
参加反应的物质及状态 | |||
1mol分子中的化学键断裂时需要吸收的能量 | 436 | a | 369 |
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1 , 蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:。
①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:。
物质 | |||