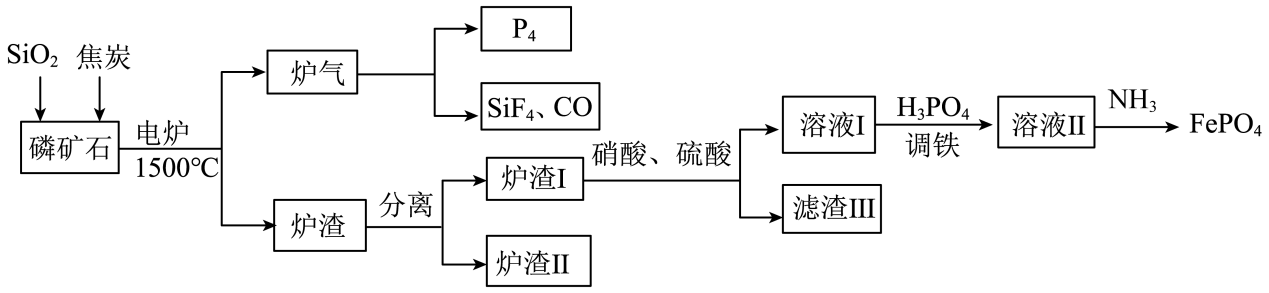
已知:①FePO4可溶于pH<2的酸性溶液。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
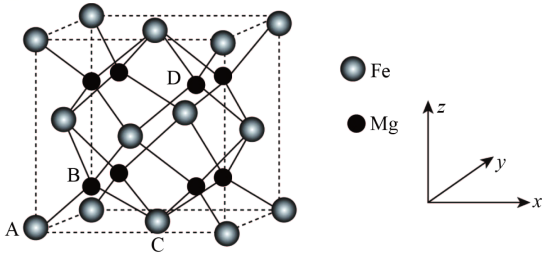
其中A的原子坐标参数为(0,0,0), B为( ,
,
),C为(
,
, 0),则D点的坐标参数为。此晶胞中Fe的配位数是。

已知:①;
②室温下,部分离子浓度的对数与
的关系如下图所示(其中
和
分别代表含铝、含硅和含锌微粒):

回答下列问题:

已知:①铂系元素(包括Pt、Pd等六种元素)的单质均为惰性金属;
②性质较稳定,难溶于酸、碱,可溶于王水;
③、
。
回答下列问题:


已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于或等于)时的pH如下表。
离子 | |||
开始沉淀的pH | 7.6 | 1.9 | 4.4 |
完全沉淀的pH | 9.6 | 3.1 | 5.6 |

①该晶胞中含铬原子的个数为。
②铬原子的配位数为。
③铬原子之间的最短距离为nm(用含a的代数式表示)。

已知:①部分金属离子沉淀的pH如表。(开始沉淀的pH按离子浓度为1.00mol•L-1计算,离子浓度小于1.0×10-5mol•L-1时,认为该离子沉淀完全)
金属离子 | Fe2+ | Fe3+ | Mn2+ |
开始沉淀的pH | 6.3 | 1.5 | 7.8 |
沉淀完全的pH | 8.3 | 2.8 | 10.1 |
②本实验条件下:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4。
回答下列问题:
a.NaOH溶液 b.Na2CO3溶液 c.H2O2溶液 d.KMnO4溶液
在实际生产过程中,此步骤也可用加入MnO2粉来除去Fe2+ , 其原理和优点是。