
使用催化剂的曲线是(填“甲”或“乙”),该催化剂可使反应历程中决速步骤的活化能降低eV,平衡转化率(填“增大”“减小”或“不变”)。达到化学平衡后再升高温度,正反应速率(填“加快”或“减慢”),平衡(填“正向”“逆向”或“不”)移动。

已知:选择性是指生成目标产物所消耗的反应物的物质的量与参与反应的反应物的物质的量之比。图中表示平衡转化率的曲线是(填“a”“b”或“c”),其如图变化的原因是。
|
|
|
|
甲 | 乙 | 丙 | 丁 |
反应Ⅰ
反应Ⅱ
反应Ⅲ
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的实际转化率、
实际选择性与
平衡选择性随温度的变化如图所示.
的选择性
. 下列说法不正确的是( )

①恒容条件下,再通入一定量的NH3 ②增大体系容积③恒容条件下,再通入一定量的N2 ④适当升高温度
化学键 | |||
能量/ | 436 | 391 | 946 |
工业合成氨反应中若完全反应,放出
热量。
①为了提高正反应的速率,下列措施可行的是
A.充入氦气 B.升高温度 C.使用催化剂 D.移除
②若恒容容器的体积为 ,
后
, 则此段时间内
;
③下列事实能够说明该反应达到化学平衡状态的是(填字母)
A.和
的物质的量之比为
B.混合气体的平均相对分子质量不再变化
C.
D.断开1个键同时形成2个
分子
实验编号 |
|
| 催化剂的比表面积( | |
1 | 280 | 82 | ||
2 | 280 | 124 | ||
3 | 350 | a | 82 |
请回答:①表中;
②此实验验证的影响因素除了催化剂的比表面积还有,
能证明该因素对反应速率的影响规律的实验编号为;
③已知催化剂不会改变反应的限度,请在右图中画出实验2从起始到时刻的
变化曲线。


回答下列问题:

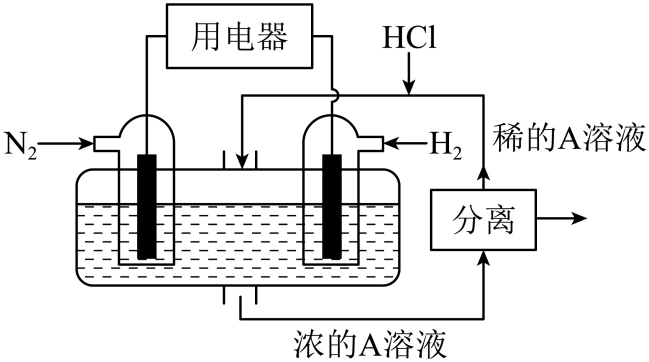
①A化学式为。
②电池正极的电极反应式为。
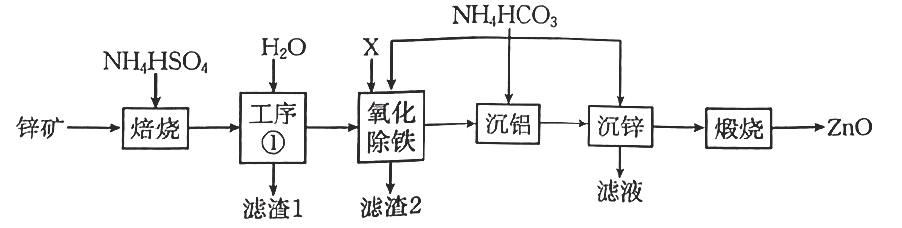
已知:①“焙烧”时金属元素生成硫酸盐。
②下,
的
的
,
的
。
③当离子浓度时,可视为沉淀完全。
回答下列问题: