
已知:①“溶浸”后的溶液pH=1,所含金属离子主要有:Zn2+、Fe3+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4氧化Mn2+时,产物中含Mn元素物质只有MnO2。
③氧化性强弱顺序:Ni2+>Cd2+>Zn2+。
④相关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
回答下列问题:
②“调pH”时,可替代ZnO的一种含锌化合物是。(用化学式表示)
③“调pH”时,若pH=5.5,此时溶液中Zn2+的最大浓度c=mol/L。


已知:①在酸性溶液中以
或
形式存在,氧化性环境中主要存在
;
②在
易分解为
难溶于水;
③。
回答下列问题:


ⅰ.
ⅱ.
ⅲ.
①
②保持温度为T,在2L密闭容器中发生反应ⅱ,投料比 , 投料量相同,测得不同催化剂对
生成量的影响如下图所示。下列说法正确的有。

A.使用催化剂A,前4min内反应的平均速率
B.反应活化能:
C.平衡后,使用催化剂A的容器内压强最大
D.反应物的转化率:
①已知结构如图(
、
……),则提供孤电子对的原子是;1个该配离子中存在个
键。

②Fe(Ⅱ)-EDTA()络合脱硝反应过程如下:
(a)
(b)
(c)(Fe(Ⅱ)-EDTA再生)
(d)(副反应)
步骤(c)所用试剂除外,还可选择(选“葡萄糖”或“乙酸”);为了抑制步骤(d)副反应的发生,可选择的试剂为(选“
”或“NaClO”)。
③会与溶液中的
形成多种配合物。当
时,溶液中主要存在下列两个平衡:
改变起始浓度,测得平衡时
、
和
的物质的量分数
随
的部分变化如图所示。

已知: , 若Q点
对应的起始浓度
(Ⅰ)求Q点溶液中;
(Ⅱ)计算Q点溶液中的平衡转化率。(写出计算过程,已知
)
萃取剂 | 萃取余液中金属质量浓度/(g/L) | Co的萃取率% | 分相时间 | |
Co | Ni | |||
7401 | 3.10 | 13.5 | 48.0 | 2min |
7402 | 2.85 | 13.7 | 52.5 | 5min |
P507 | 0.03 | 13.8 | 99.5 | 1min |

若A坐标参数为 , B为
, 则C坐标参数为。其中Ni原子位于O原子围成的空隙中。(填“四面体”、“立方体”、“八面体”)

①在三组100mL12mg•L-1的B溶液中分别加入0.075gHgO,在不同波长的可见光照射下做光催化活性测试,溶液中某时刻B的浓度c与初始浓度c0的比值随光照时间t的变化如下图所示,三条曲线产生差异的原因可能是。

②0~15min内,470nm可见光照射下B的降解速率为mg•L-1•min-1。

①从上图可知,CH2=CHOH(aq)→CH3CHO(aq) ∆H=(用相对能量E表示)。
②下列说法正确的是。
A.本反应历程涉及的物质中,CH2=CHOH最不稳定
B.过程①中,Hg2+的空轨道接受水分子中氧原子的孤对电子
C.该反应历程中,存在非极性键的断裂和形成
D.增大压强和乙炔的浓度均能加快反应速率,并且增大乙炔的平衡转化率
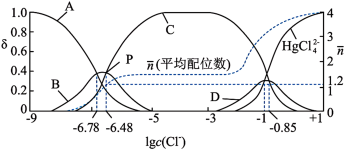
已知:平均配位数
①图中能代表HgCl2曲线是(填字母),平衡常数K4=。
②在P点,溶液中c(HgCl2):c(Hg2+)=(写出计算过程)。

已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液;②常温下Ksp[Fe(OH)2]=4.0×10-16 , Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=3.0×10-33 , lg2=0.3。
回答下列问题:

实验序号 | 操作 | 现象 | |
实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液

①在实验ii-a的基础上继续加入,即可成功配制。
②验证配制成功![]() 操作及实验现象是:;反应的离子方程式为:。
操作及实验现象是:;反应的离子方程式为:。