
Ti元素在周期表中的位置是。

M电极为极(填“正”或“负”),该电极反应方程式为。

金属离子 | ||||
开始沉淀时的pH | 6.8 | 2.2 | 7.5 | 9.4 |
沉淀完全时的pH | 9.2 | 3.2 | 9.0 | 12.4 |

温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 280℃ |
晶体形态 | 多种结晶水合物 |

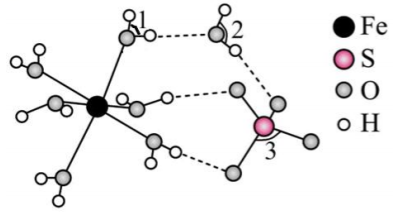 图示
图示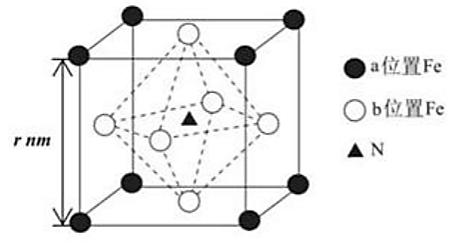
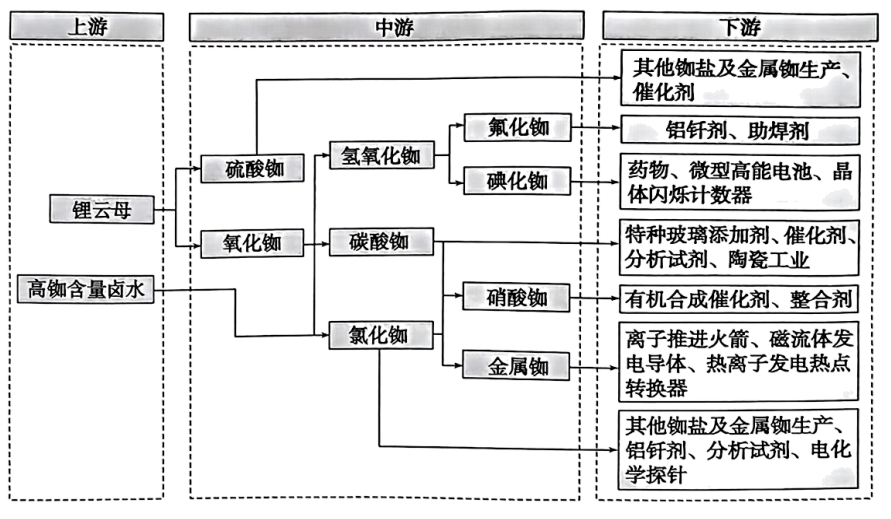
①从卤水中分离铷离子常用离子交换法,而离子大小是影响交换效果的因素,铷的离子半径(填“小于”或“大于”)钾的离子半径。
②写出由氧化铷制备氢氧化铷的化学方程式。
③离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是。
硅元素在地壳中的含量仅次于氧。人类很早就利用硅酸盐烧陶制瓷、获得玻璃制品。
1824年,人类成功提炼出硅单质。由石英砂制高纯硅的过程如下:
![]()
如今,半导体“硅”已经成为信息时代高科技的代名词。由于硅元素储量丰富,且单晶硅具有优异的耐高温与抗腐蚀性能,所以单晶硅成为制造大规模集成电路(俗称“芯片”)的基底材料。
整个芯片制造过程需要许多高精密度的专业设备,其中不乏我国目前还未完全掌握而被“卡脖子”的技术。我国科学家正开发“碳基”芯片来替代硅基芯片,习近平主席评价此项研究“另辟蹊径,柳暗花明”。
①请依据以上短文,下列说法正确是。
A.硅元素在自然界中以游离态(单质)形式存在,石英砂的主要成分是SiO2
B.单晶硅做芯片的基底材料与硅元素储量丰富,单晶硅导电性好、耐腐蚀性能优异有关
C.制备单质硅的过程中焦炭过多容易生成副产物金刚砂
D.碳和硅在周期表中位于同一主族,性质相似,因此“碳基”芯片有望替代硅基芯片
②制备高纯硅过程必须严格控制无水无氧,因为SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式。
③有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,化学性质活泼,可在空气中自燃,写出乙硅烷在空气中自燃的化学方程式。