①甲基丙烯酸中杂化的碳原子与
杂化的碳原子的个数之比为,甲基丙烯酸钠中含有的化学键类型有。
②过渡元素离子与水形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为或
排布时,无颜色;为
时,有颜色,如
显粉红色。据此判断,
(填“有”或“无”)颜色。
选项 | 已知信息 | 推论 |
A |
|
|
B | 电负性: | 第一电离能: |
C | 沸点: | 非金属性: |
D | 原子半径: | 离子半径: |

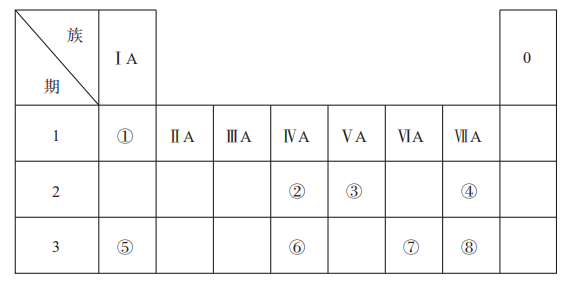
①2p=3p ②4s>2s ③4p>4f ④4d>3d
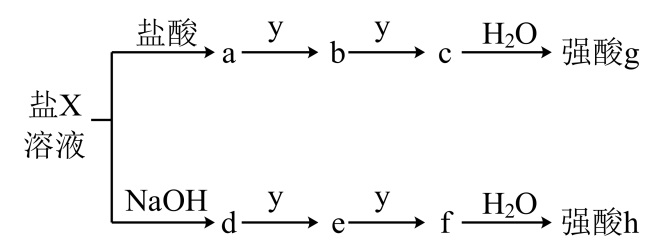
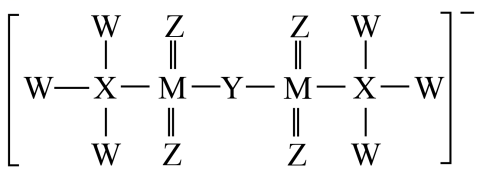

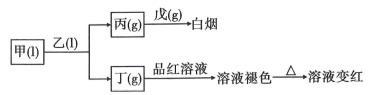
已知:乙、戊分子都含有10个电子,且两种分子中心原子的杂化方式均为杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题: