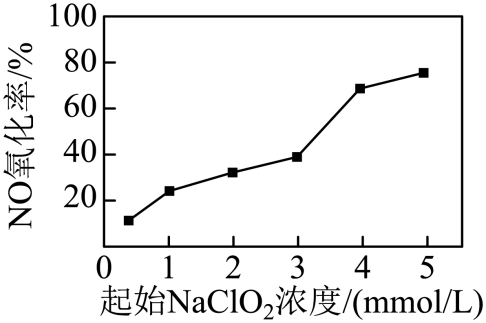
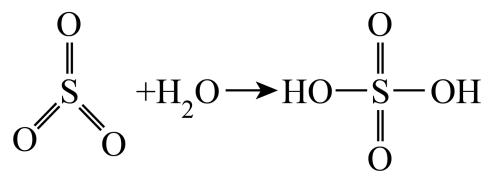
 , 请写出焦硫酸的结构式。
, 请写出焦硫酸的结构式。

 表示爆炸类物质
B .
表示爆炸类物质
B . 
(i) I2(?)+H2(g)2HI(g) (该反应完全发生,放热9.48kJ)
(ii) I2(?)+H2(g)2HI(g) (该反应完全发生,吸收26.48kJ)
实验目的 | 方案设计 | 现象 | 结论 | |
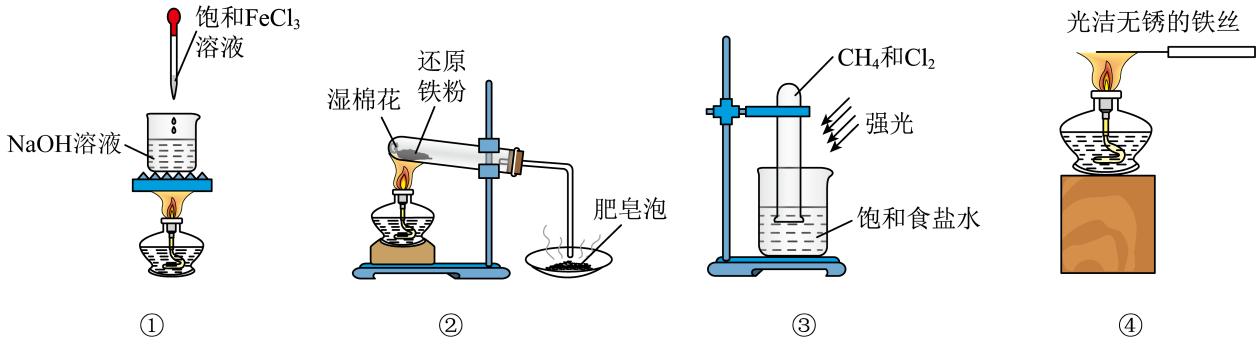
A | 检验固体样品中是否含有NH | 将固体样品加水溶解,滴入浓NaOH溶液并加热,试管口放一张湿润的红色石蕊试纸 | 湿润的红色石蕊试纸变蓝 | 样品中含有NH |
B | 探究铝与浓硫酸的钝化现象 | 室温下,将铝片直接放入浓硫酸中,一段时间后取出并用水洗净,放入CuSO4溶液 | 铝片表面未见紫红色固体生成 | 室温下浓硫酸能将铝片钝化 |
C | 探究Si、Cl元素非金属性的强弱 | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入盐酸至红色褪去 | 混合液逐渐变成白色凝胶 | 非金属性:Si<Cl |
D | 探究浓度与反应速率的关系 | 两支试管各盛4mL 0.01mol/L酸性高锰酸钾溶液,分别加入2mL 0.1mol/L草酸溶液和2mL 0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
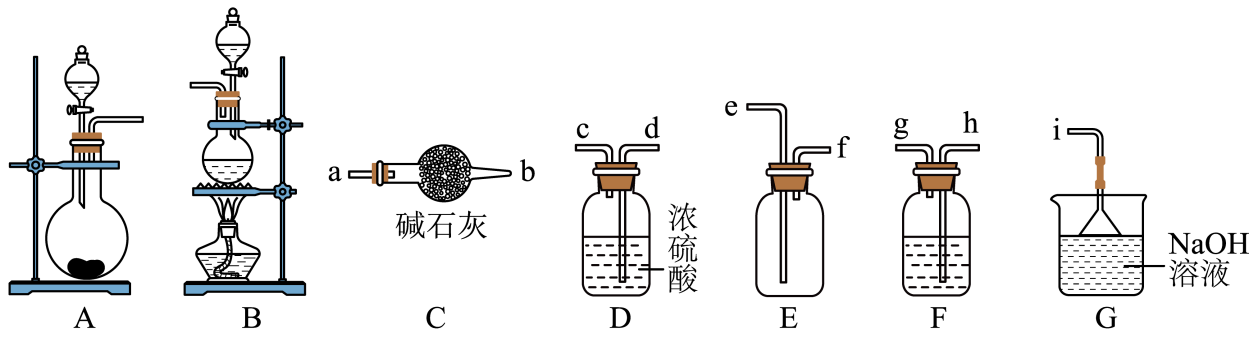
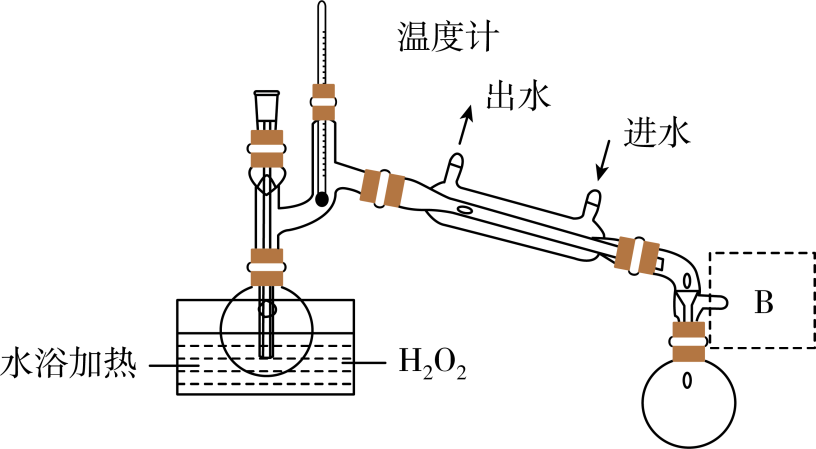
制备氯气的离子方程为。
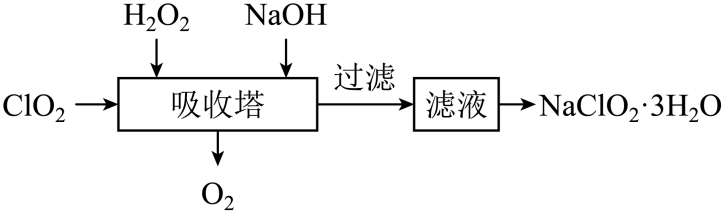
吸收塔内发生反应的化学方程式为。