ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
已知:①主要副反应为
②温度过高会引发烃裂解生成炭(C)。
③相关化学键的键能如下所示:
化学键 | ||||
键能 | 615 | 436 |
请回答:
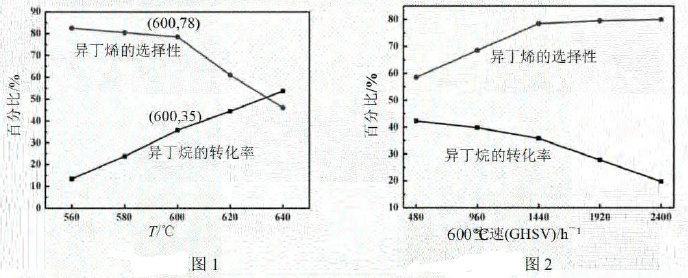
①图1中,600℃时异丁烯收率。
②下列说法正确的是。
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是。
④其他条件相同,异丁烷的平衡转化率如图3所示。若充入改为2mol,在图3中作出异丁烷的平衡转化率随温度变化的曲线(忽略积碳的影响)。

图a装置 | 图b装置 | 图c装置 | |
80s时反应区 | x |
下列说法正确的是( )
实验目的 | 实验方案设计 | 现象 | 结论 | |
A | 探究 | 向 | 溶液变蓝色 | 氧化性: |
B | 比较 | 常温,测定 | 结合 | |
C | 探究温度对化学平衡的影响 | 将 | 加热后溶液为黄绿色,冷水中变为蓝绿色 | 说明降低温度
|
D | 比较AgCl与 | 向含有浓度均为 | 先生成白色AgCl沉淀 | Ksp: |
机理Ⅰ:C2H6→CH3CHO
机理Ⅱ:C2H6→CH3CH2OH→CH3CHO
机理Ⅲ:C2H6→C2H4→CH3CHO
已知下图是乙烷选择氧化生成乙醛的一种反应历程的过渡态、中间体和产物的稳定几何构型。
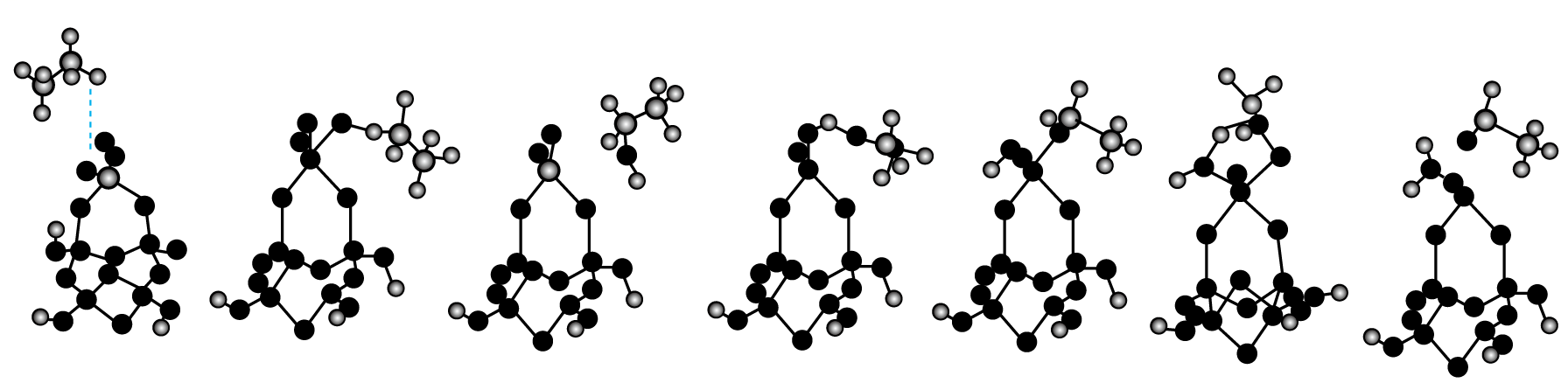
请回答下列问题:
化学键 | C-H | O-H | O=O | C=O | C-C |
键能kJ·mol-l | 413.4 | 426.8 | 497.3 | 750 | 347.7 |
①反应。升高温度活化分子百分数将(填“增大”或“不变”或“减小”)。
②温度下,在
的刚性密闭容器中按一定比例
加入
和
发生反应,平衡时
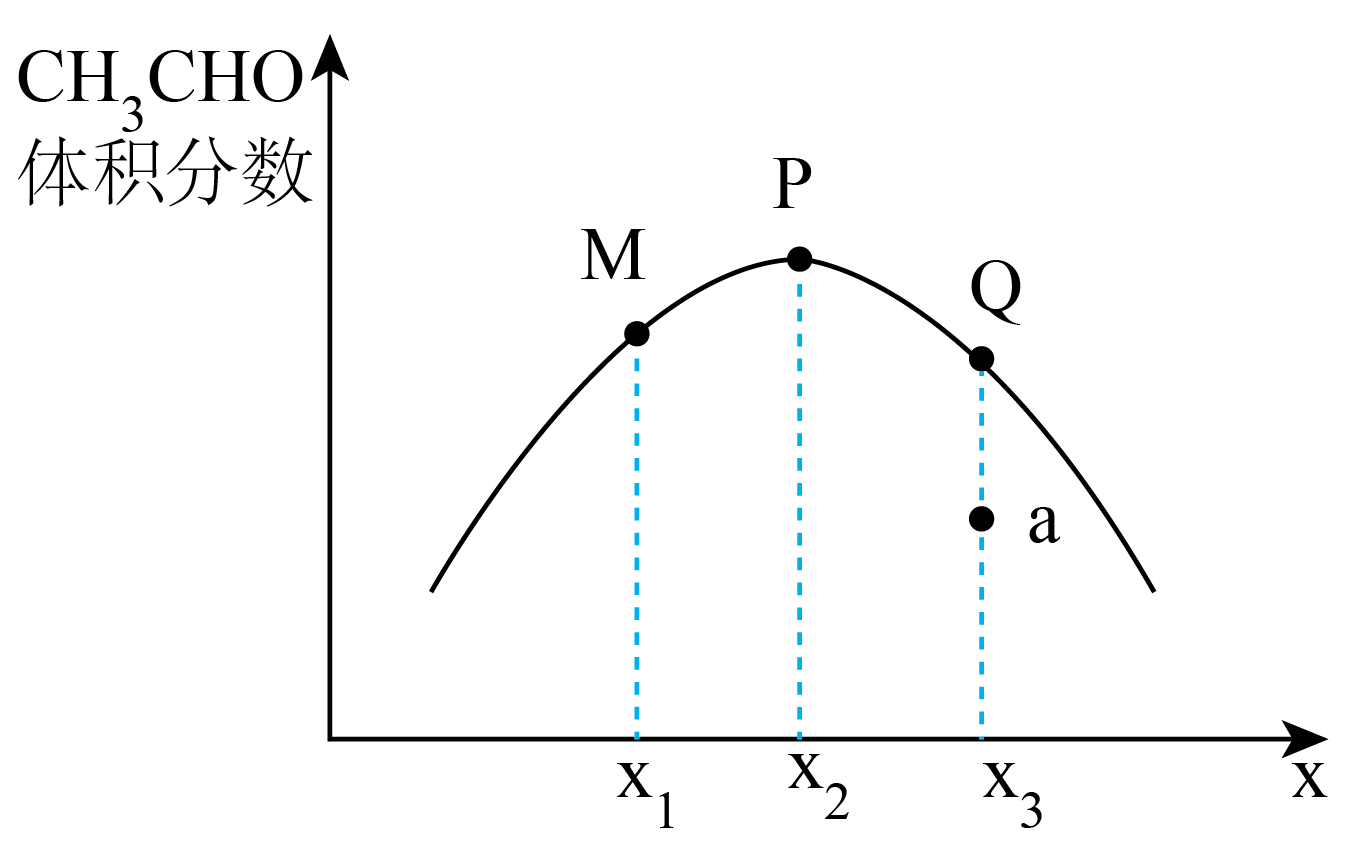
的体积分数与
的关系如图所示。图中P点的横坐标
;乙烷转化率最大的是点(填“M”或“P”或“Q”);若要缩短a点至Q点所用的时间,可采取的措施有(答出一条即可)。
选项 | 实验 | 现象 | 结论 |
A | 向两份等体积等浓度的新制氯水中,分别滴加AgNO3溶液和淀粉KI溶液 | 前者产生白色沉淀,后者溶液变为蓝色 | 氯气与水的反应存在限度 |
B | 将苯与液溴在催化剂作用下产生的气体通入硝酸银溶液中 | 产生淡黄色沉淀 | 苯和液溴发生取代反应 |
C | 向1mL0.01mol·L-1MgCl2溶液中滴入2滴0.01mol·L-1NaOH溶液,产生白色沉淀,再滴入2滴0.01mol·L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 向溶有SO2的CaCl2溶液中通入气体X | 产生白色沉淀 | X一定具有强氧化性 |
I.
Ⅱ.
Ⅲ.。
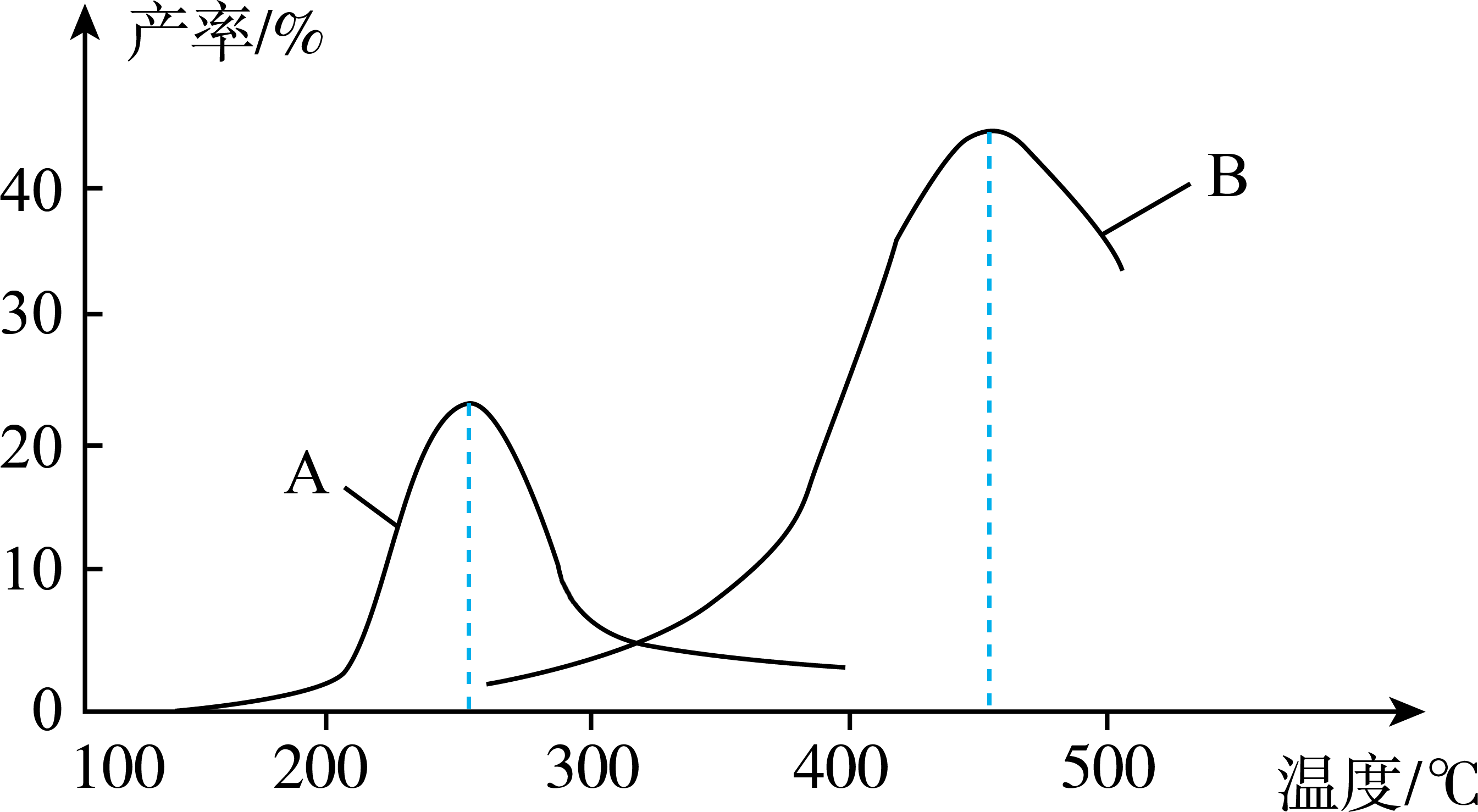
①下列说法正确的是(填序号)。
A.使用催化剂B的最佳温度约为250℃
B.相同条件下,改变压强会影响的产率
C.催化剂不仅能改变反应速率,还能改变平衡时的产率
D.两种催化剂均能降低反应的活化能,但不能改变的数值
②在催化剂A作用下,温度低于200℃时,的产率随温度升高变化不大,主要原因是。
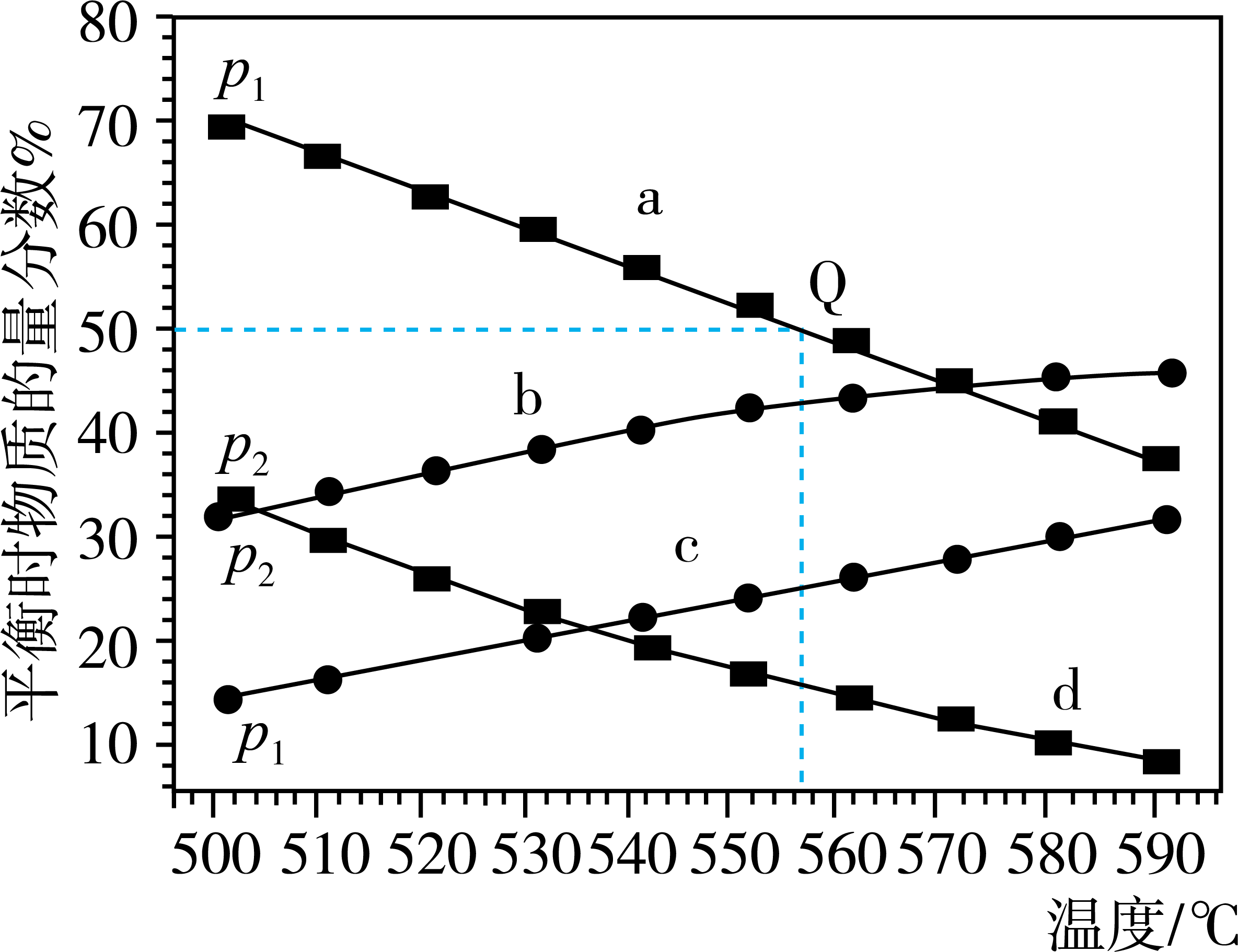
①b、c代表(填“丙烷”或“丙烯”),(填“大于”“小于”或“等于”)
②起始时充入一定量丙烷,在恒压条件下发生反应,Q点对应温度下丙烷的转化率为(用分数表示),该反应的平衡常数
=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
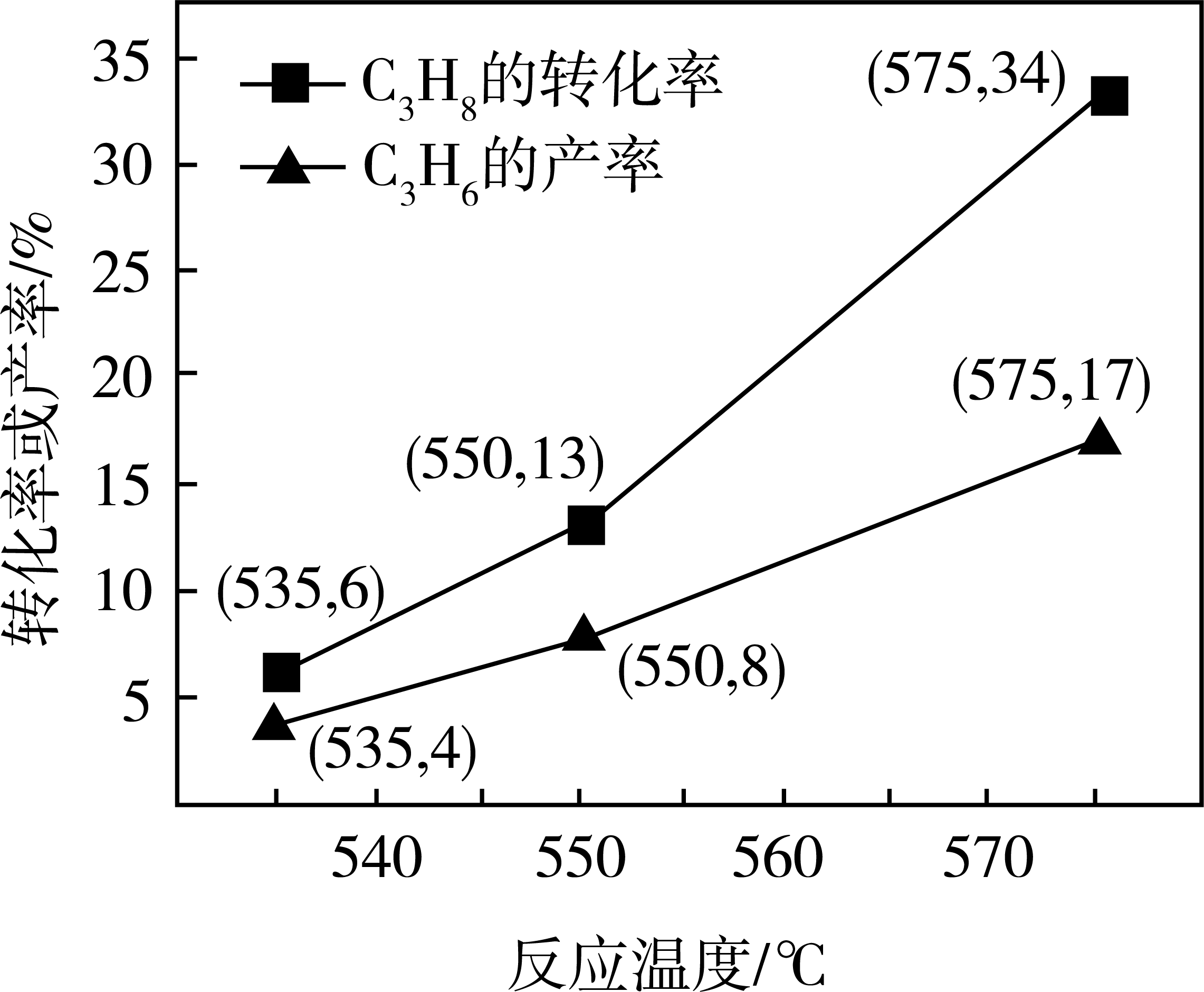
①550℃时,的选择性为%(
的选择性=
, 计算结果精确到0.1)。
②基于上述研究结果,能提高的选择性的措施是。
| 实验目的 | 实验药品 |
A | 探究温度对化学平衡的影响 |
|
B | 验证乙醇的消去产物是乙烯 | 乙醇、酸性高锰酸钾溶液、浓硫酸 |
C | 证明牺牲阳极法保护铁 |
|
D | 比较水和四氯化碳分子的极性 |
|