ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。
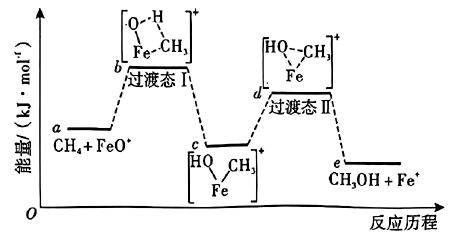
说明:过渡态中“--”表示化学键未完全断裂或形成。

图a装置 | 图b装置 | 图c装置 | |
80s时反应区 | x |
下列说法正确的是( )
机理Ⅰ:C2H6→CH3CHO
机理Ⅱ:C2H6→CH3CH2OH→CH3CHO
机理Ⅲ:C2H6→C2H4→CH3CHO
已知下图是乙烷选择氧化生成乙醛的一种反应历程的过渡态、中间体和产物的稳定几何构型。
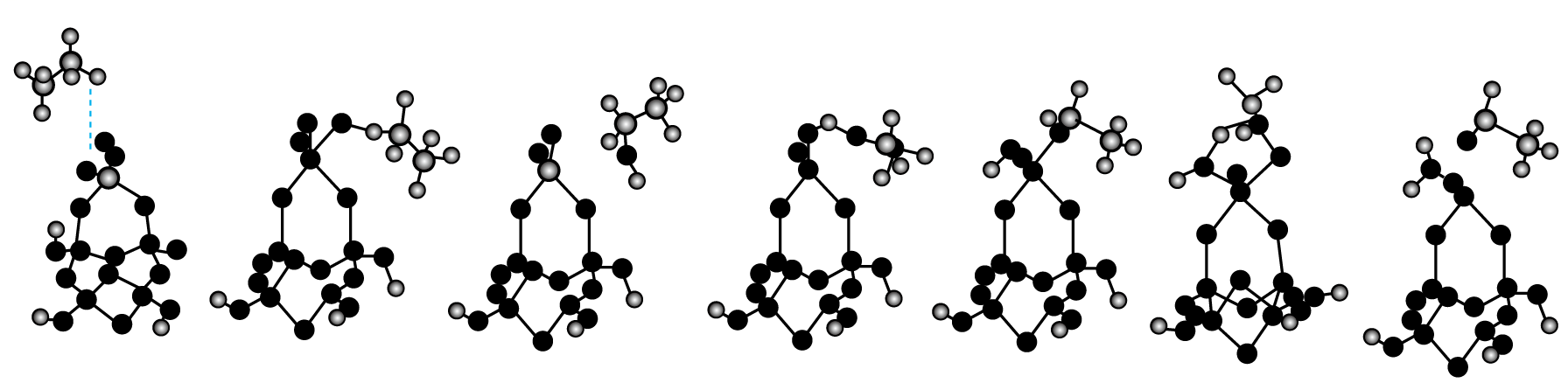
请回答下列问题:
化学键 | C-H | O-H | O=O | C=O | C-C |
键能kJ·mol-l | 413.4 | 426.8 | 497.3 | 750 | 347.7 |
①反应。升高温度活化分子百分数将(填“增大”或“不变”或“减小”)。
②温度下,在
的刚性密闭容器中按一定比例
加入
和
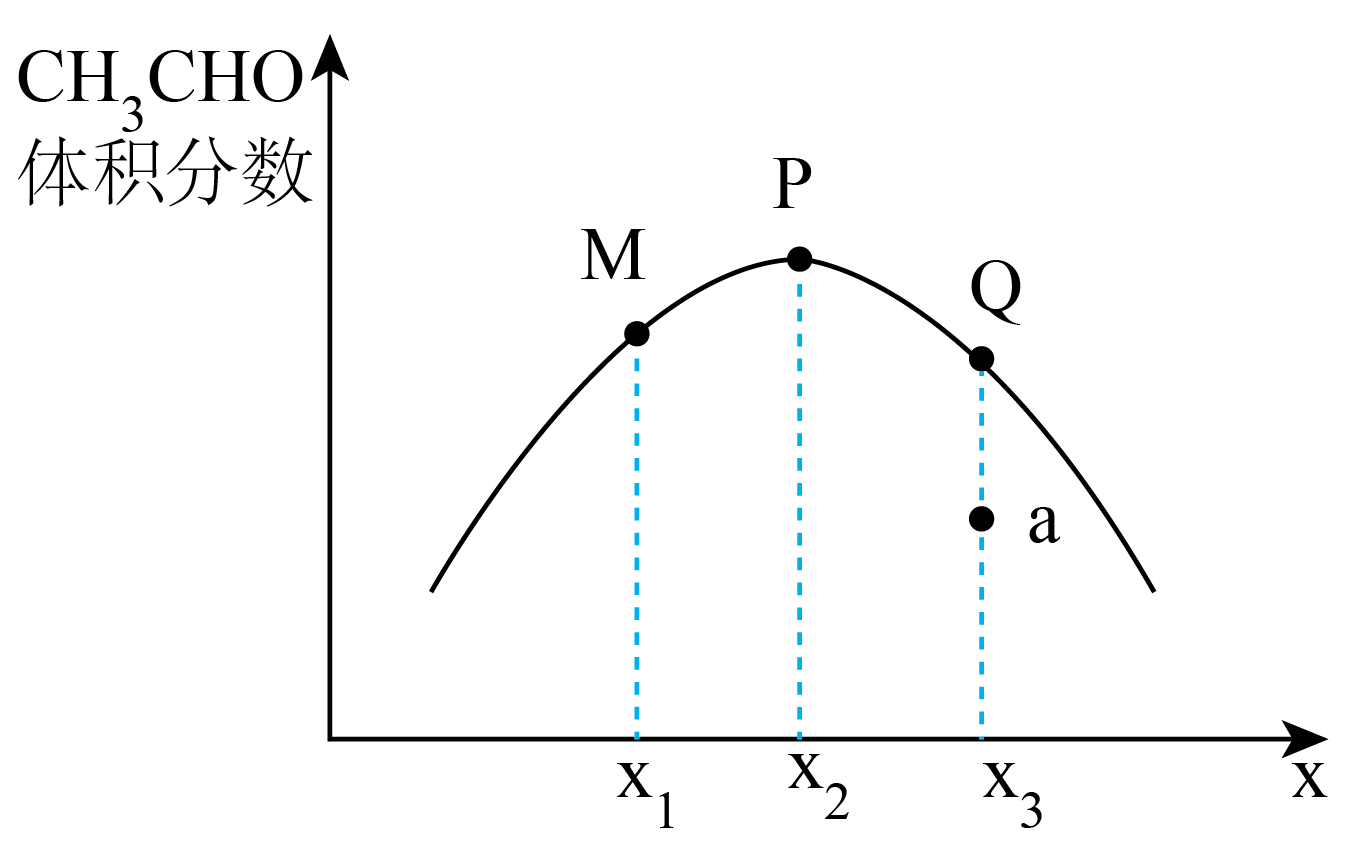
发生反应,平衡时
的体积分数与
的关系如图所示。图中P点的横坐标
;乙烷转化率最大的是点(填“M”或“P”或“Q”);若要缩短a点至Q点所用的时间,可采取的措施有(答出一条即可)。
I.
Ⅱ.
Ⅲ.。
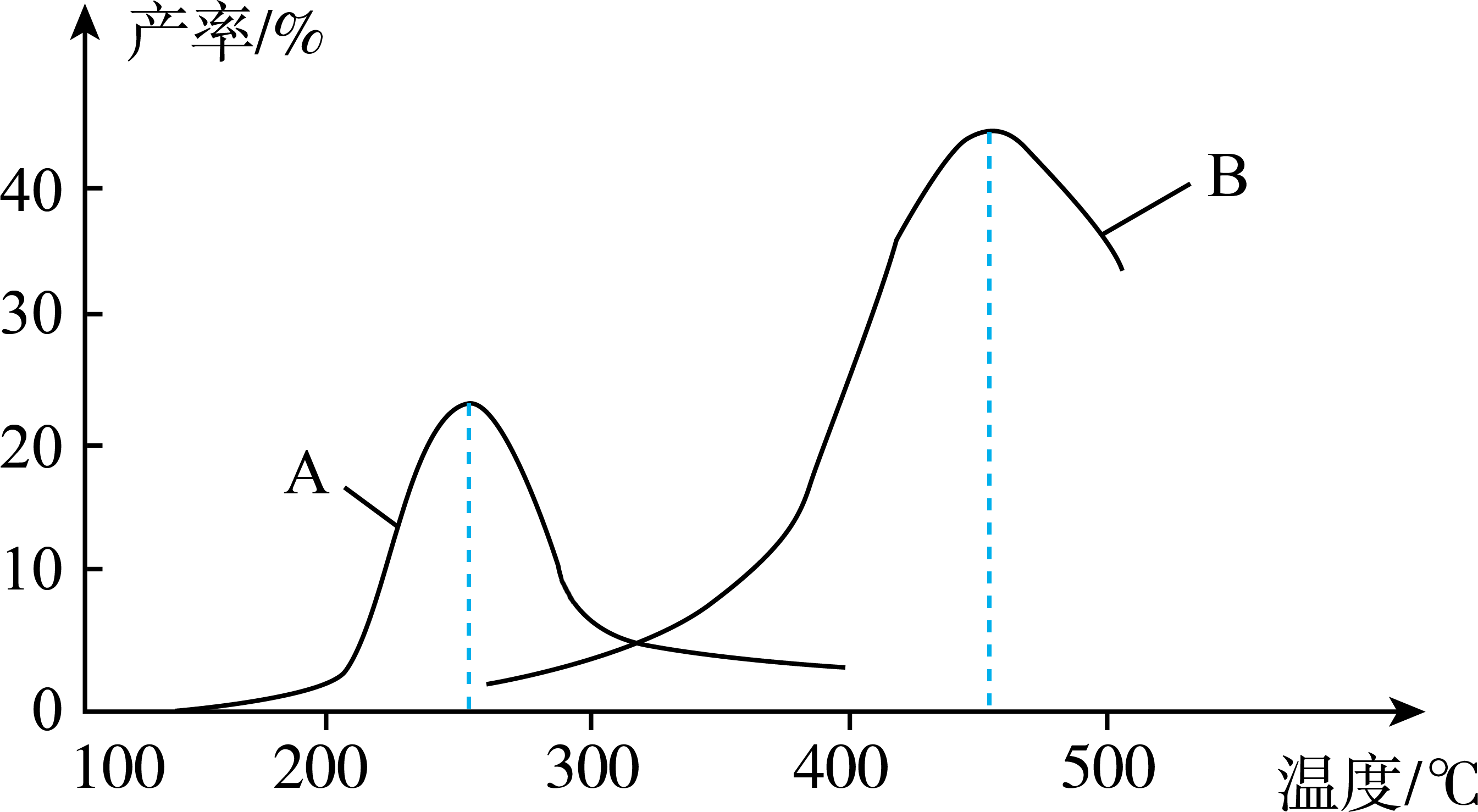
①下列说法正确的是(填序号)。
A.使用催化剂B的最佳温度约为250℃
B.相同条件下,改变压强会影响的产率
C.催化剂不仅能改变反应速率,还能改变平衡时的产率
D.两种催化剂均能降低反应的活化能,但不能改变的数值
②在催化剂A作用下,温度低于200℃时,的产率随温度升高变化不大,主要原因是。
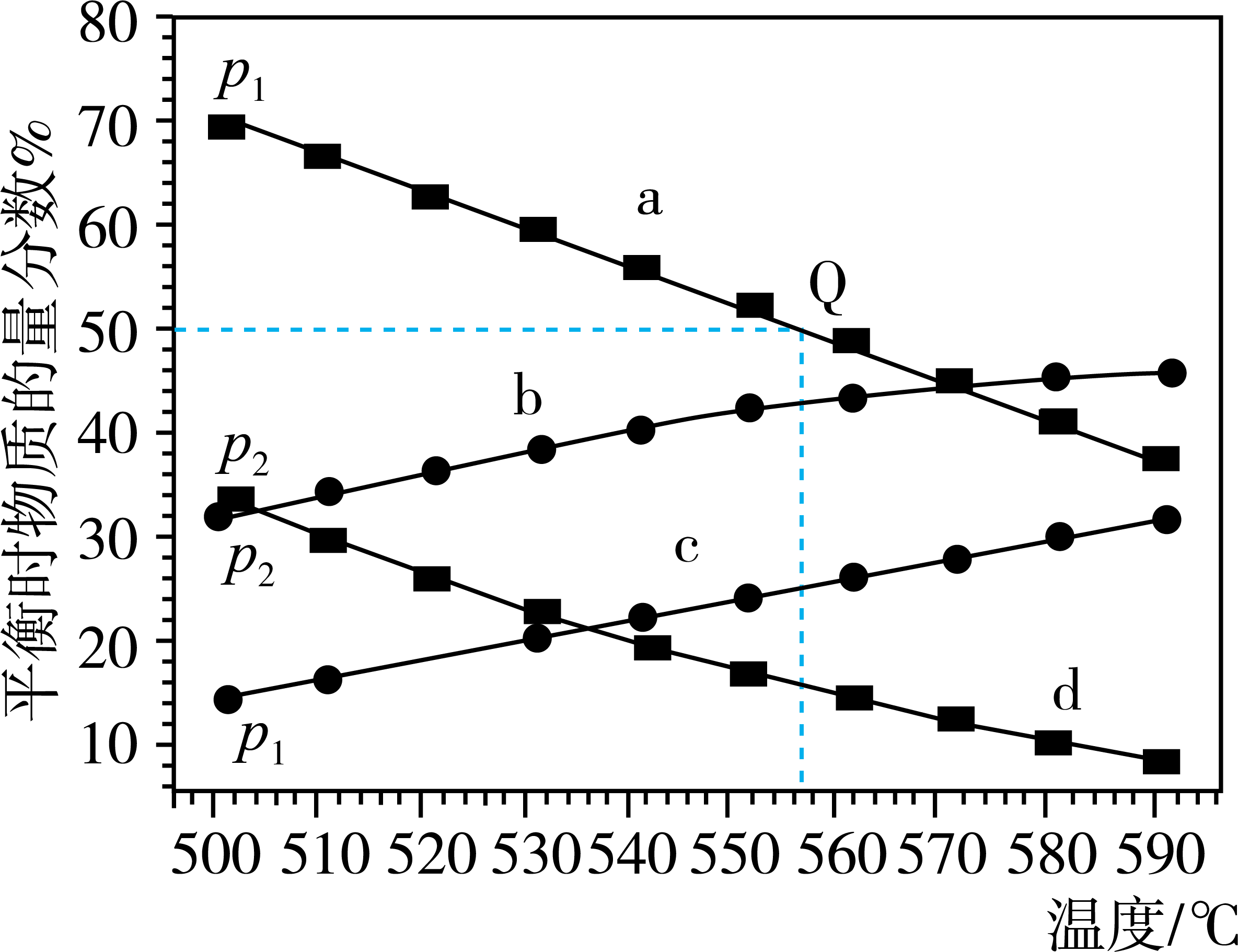
①b、c代表(填“丙烷”或“丙烯”),(填“大于”“小于”或“等于”)
②起始时充入一定量丙烷,在恒压条件下发生反应,Q点对应温度下丙烷的转化率为(用分数表示),该反应的平衡常数
=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
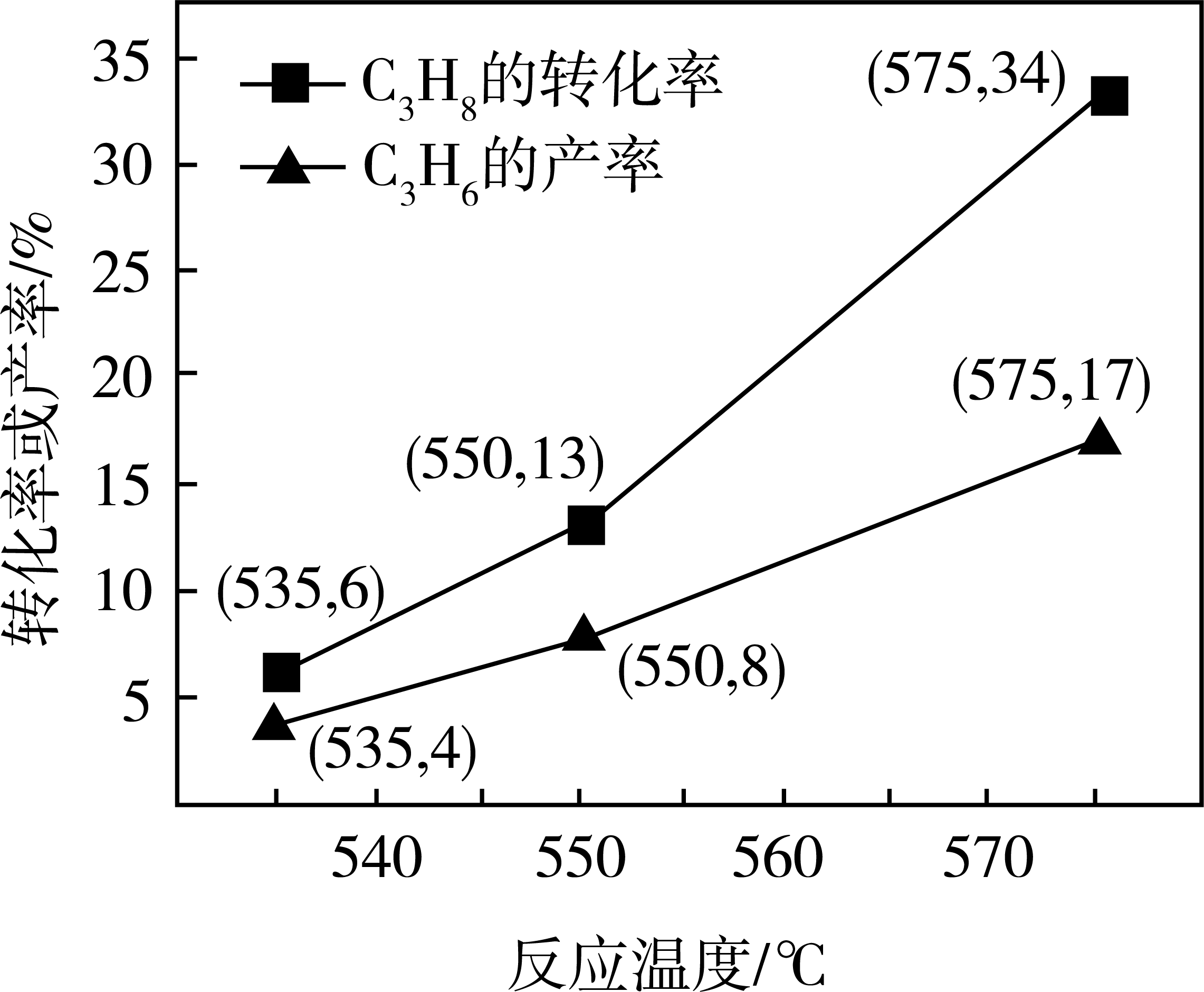
①550℃时,的选择性为%(
的选择性=
, 计算结果精确到0.1)。
②基于上述研究结果,能提高的选择性的措施是。
t℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1K2(填">”、“<”或“=”);
②400℃时,反应2NH3(g)N2(g)+ 3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正 v(N2)逆(填“>” “<”或“=”)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544kJ/mol,键能数据如下表:
化学键 | N-N | N-H | O=O | O-H |
键能/(kJ/mol) | 193 | 391 | 497 | 463 |
则氮氮三键的键能为kJ/mol。