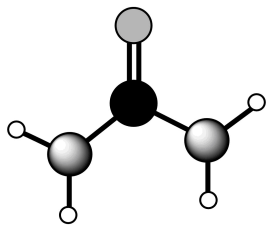

选项 | 物质结构或性质 | 解释 |
A | 键角: | CO2中C原子为sp杂化,为直线形分子;CH4中C原子为sp3杂化,为正四面体形分子 |
B | 稳定性: |
|
BF3与NH3形成[H3N→BF3] |
| |
D | 冠醚能加快KMnO4与环己烯的反应速率 | 冠醚上不同大小的空穴适配不同大小的碱金属离子,冠醚通过与K+结合将 |
 与对羟基苯甲酸
与对羟基苯甲酸 的沸点相差较大,
的沸点相差较大,根据结构分析,前者的沸点(填高于”或“低于”)后者,并解释原因:。
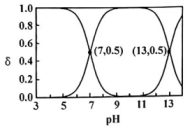
①写出的电离方程式:、。
②的
,
。
ⅰ.
ⅱ.
①反应ⅰ能自发进行的反应条件是。
②写出热解总反应的热化学方程式:。
③假设在某温度下反应ⅰ达到平衡,测得密闭系统中各组分浓度分别为、
、
。
该温度下平衡常数;达平衡后,其他条件不变,把容器的容积减小到原来的
时,结合数据用Q与K的大小关系解释平衡移动方向及其理由。
①先将通入
溶液中,产生淡黄色沉淀和浅绿色溶液(已知
是黑色难溶物)。写出该反应的离子方程式:。
②再在硫杆菌存在下通入:
在硫杆菌存在下被氧化的速率是无菌时的
倍。
ⅰ.硫杆菌的作用是;
ⅱ.由下图1和图2判断使用硫杆菌的最佳条件为;

图1 图2
ⅲ.若反应温度过高,反应速率下降,其原因是。