 D . HCl的形成过程:
D . HCl的形成过程: 温度 | 分解产物 | |
反应I | 185~200℃ |
|
反应II | 高于230℃ |
|
反应III | 高于400℃ |
|



①加热反应前通的目的是。
②A中仪器X的名称是,其作用是。
③E中收集的物质含有(写化学式)。
④尾气经处理后可循环使用。
①中存在的化学键有(填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为。
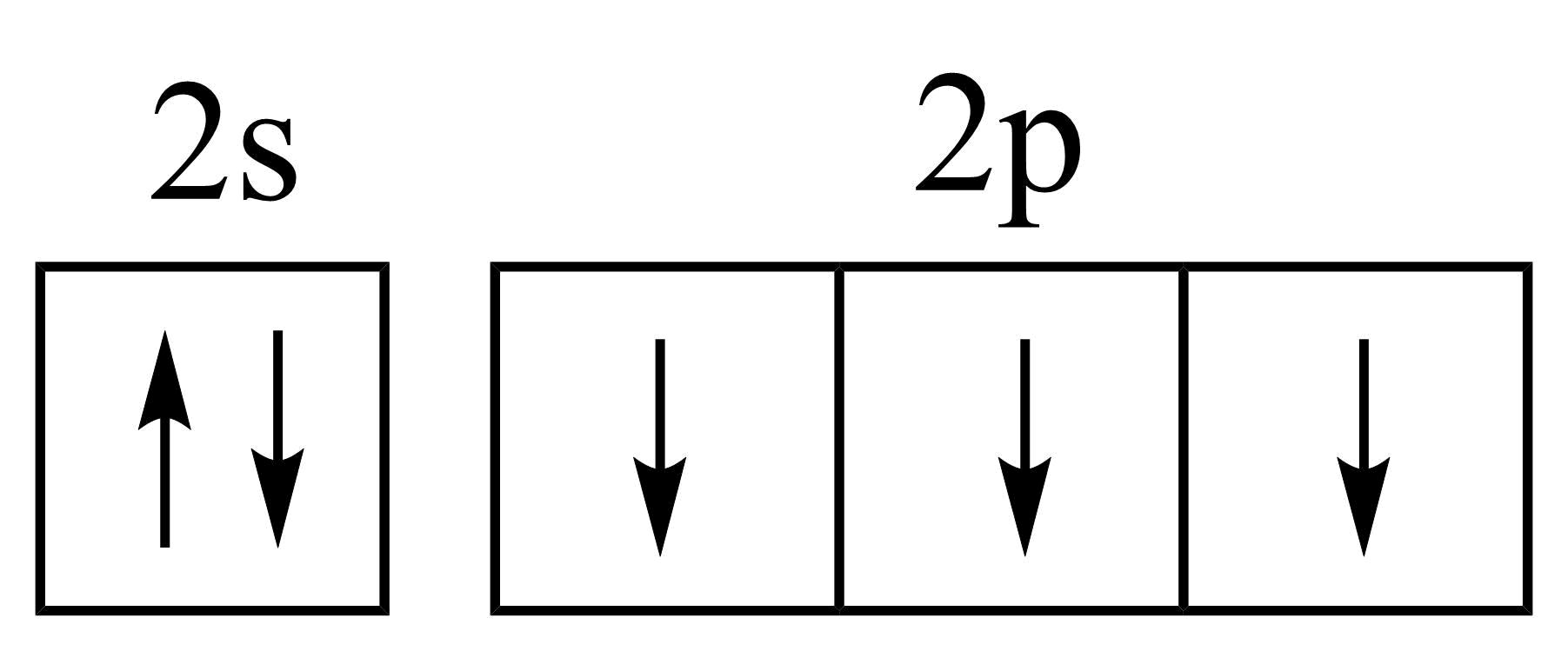 C .
C . 
已知:①;
②焦亚硫酸钠()常用作食品抗氧化剂;
③氧化性:。
回答下列问题:
a.CoO
b.
c.KOH


选项 | 实验操作及现象 | 结论 |
A | 向重铬酸钾溶液中加水,溶液颜色变浅 | 增加水的用量,平衡 |
B | 向含酚酞的 |
|
C | 向硫酸铜溶液中滴加浓氨水至过量,溶液先产生蓝色沉淀,然后沉淀溶解变为深蓝色溶液 |
|
D |
|
|