
下列说法错误的是( )
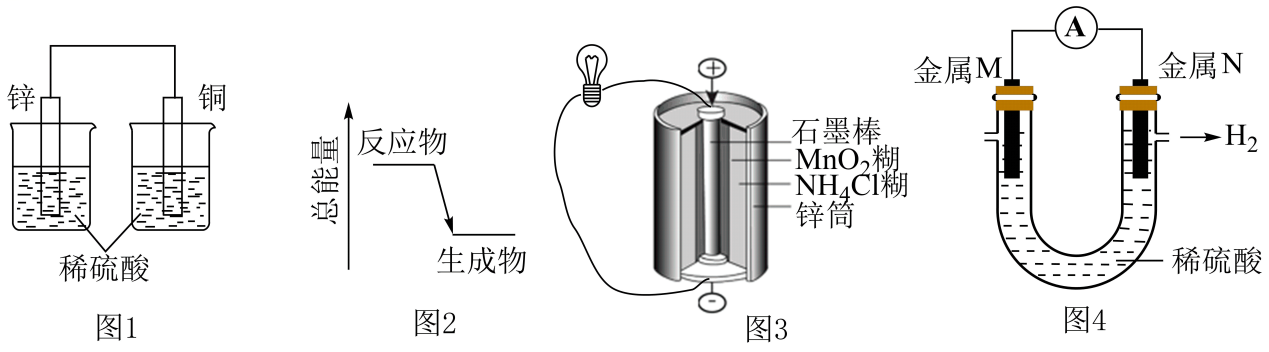
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。
则该反应自发进行的条件是:,。
A.恒温条件下,体系中混合气体密度不再随时间变化能说明反应达到平衡
B.绝热条件下,反应Ⅰ平衡常数K不再随时间变化而变化说明该反应达到平衡
C.其他条件不变,升高温度,能提高相同时间内处理的量
D.其他条件不变,提高碳氮比可能会提高平衡体系中
的物质的量分数
①该温度条件下反应Ⅰ平衡常数。
②随时间变化数据如下表,一定条件下反应时间t与
的转化关系如下图:

温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
1.00 | 0.70 | 0.50 | 0.20 | 0.20 | ||
1.00 | 0.60 | 0.36 | … | 0.30 |
依据上表数据分析,请在时间t与的转化关系图中标示
,
(假设
)条件下的变化曲线(要求有必要标注)
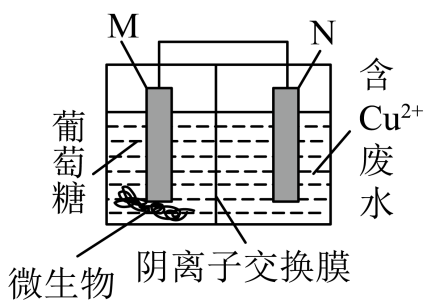

回答下列问题:

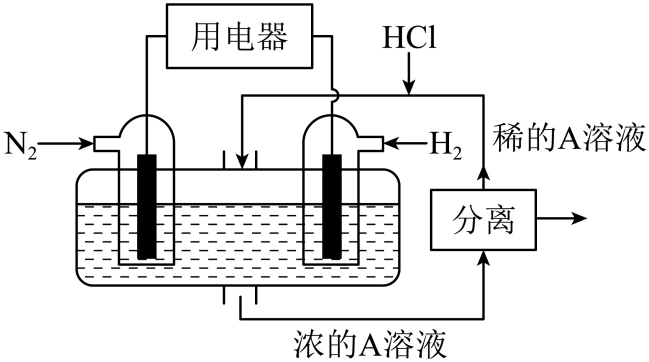
①A化学式为。
②电池正极的电极反应式为。