①配制100mL一定浓度的溶液需用到的仪器有(填字母)。

②配制溶液时,需要将
固体溶解在浓盐酸中,原因为。
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液的体积为20.00mL,已知:
, 则该
溶液的浓度为
。
预测现象1:向溶液中加入
溶液,溶液由黄色变为浅绿色。作出该预测的原因为(用离子方程式表示)。
预测现象2:向溶液中加入
溶液,生成红褐色沉淀。
序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 20 | |
0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 | |
38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 | |
现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
①请补充表格中的数据:a=。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是。
③实验ⅵ和ⅶ的实验现象说明溶液中的水解与
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:。
④甲同学认为实验ⅵ和ⅶ中,与
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(填实验操作与现象),则说明猜想成立。

回答下列问题:
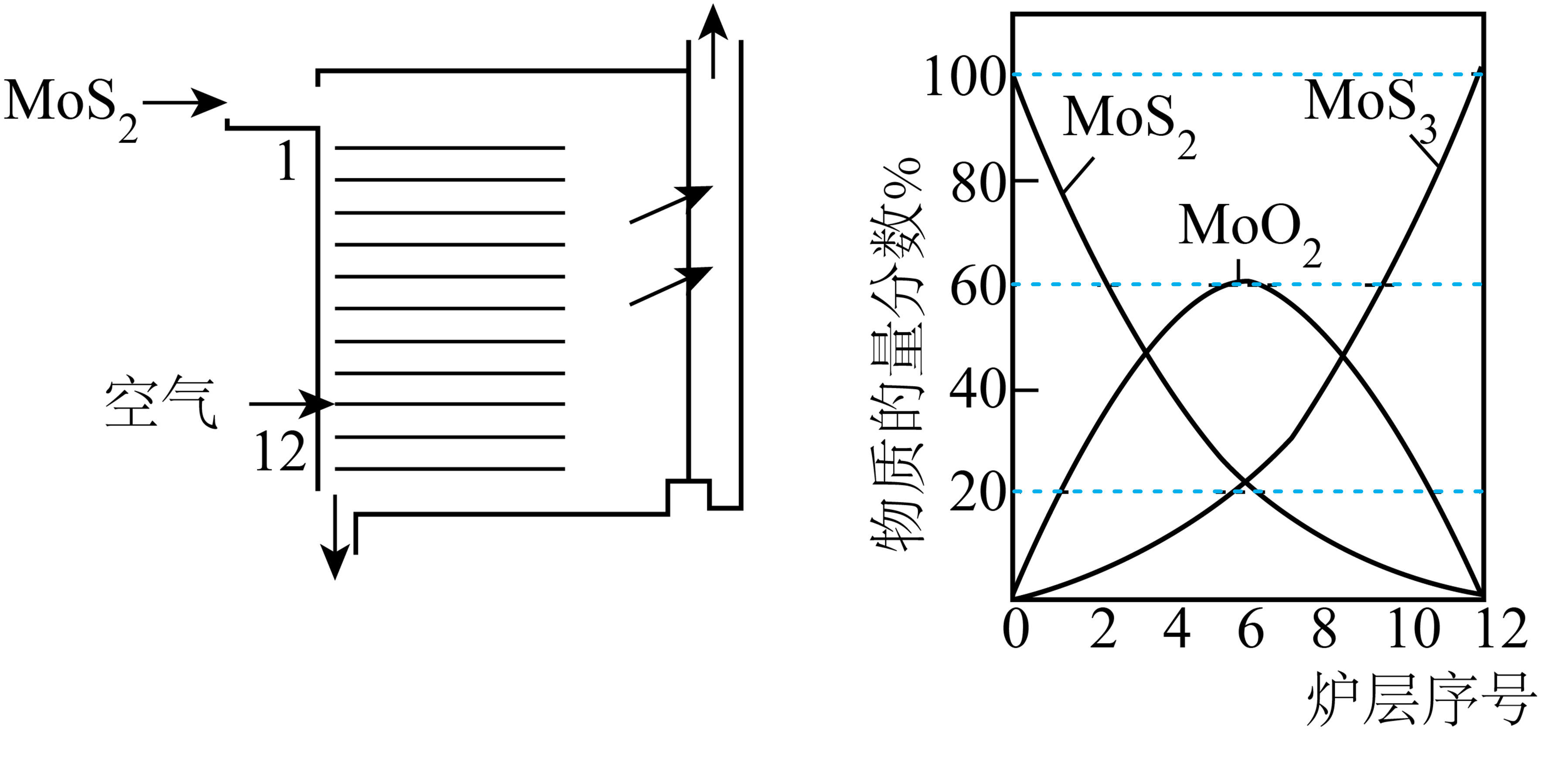
①多层逆流焙烧的优点是(任答一点)。
②固体1的成分有、CuO和Fe2O3。

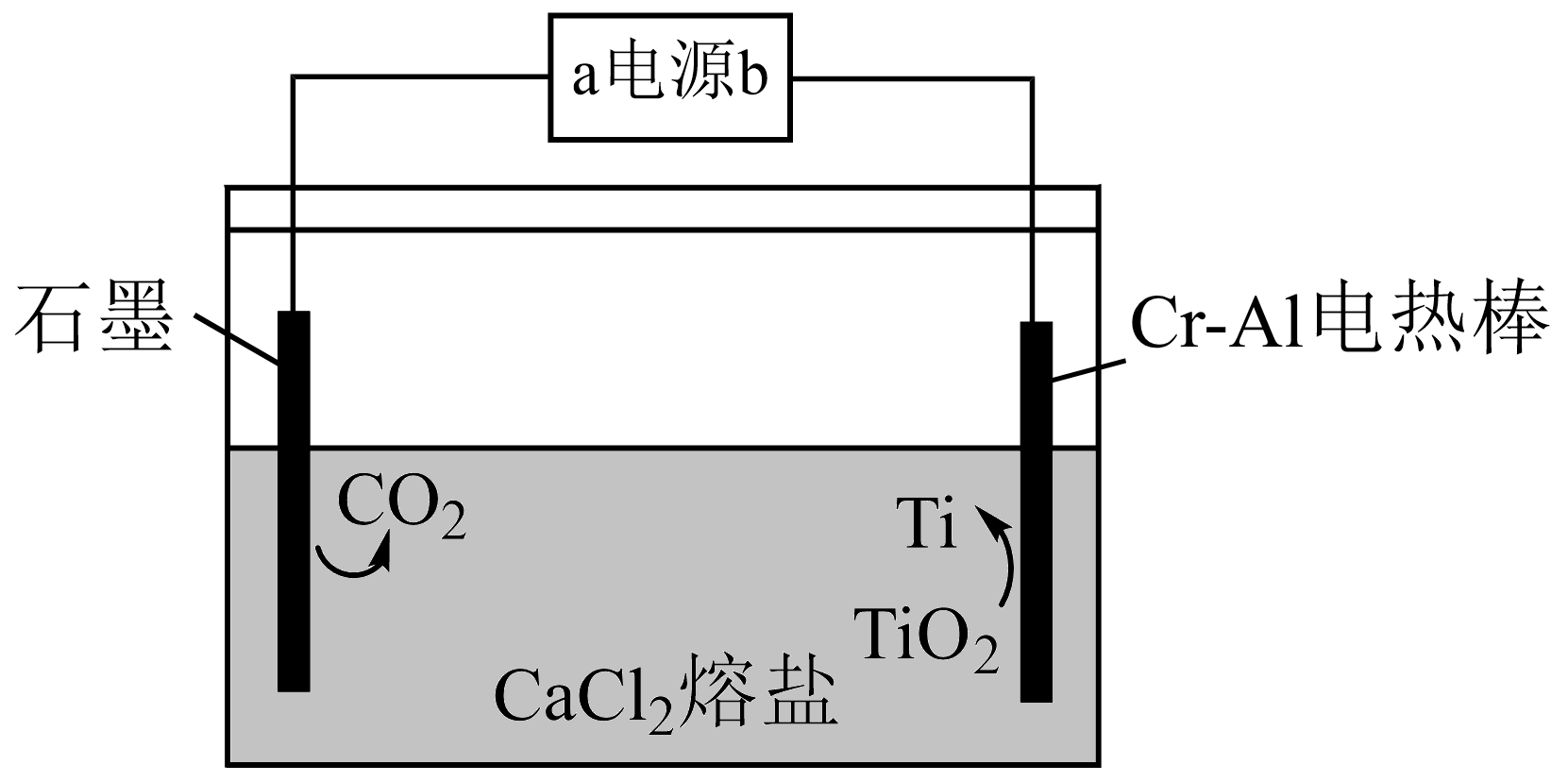
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
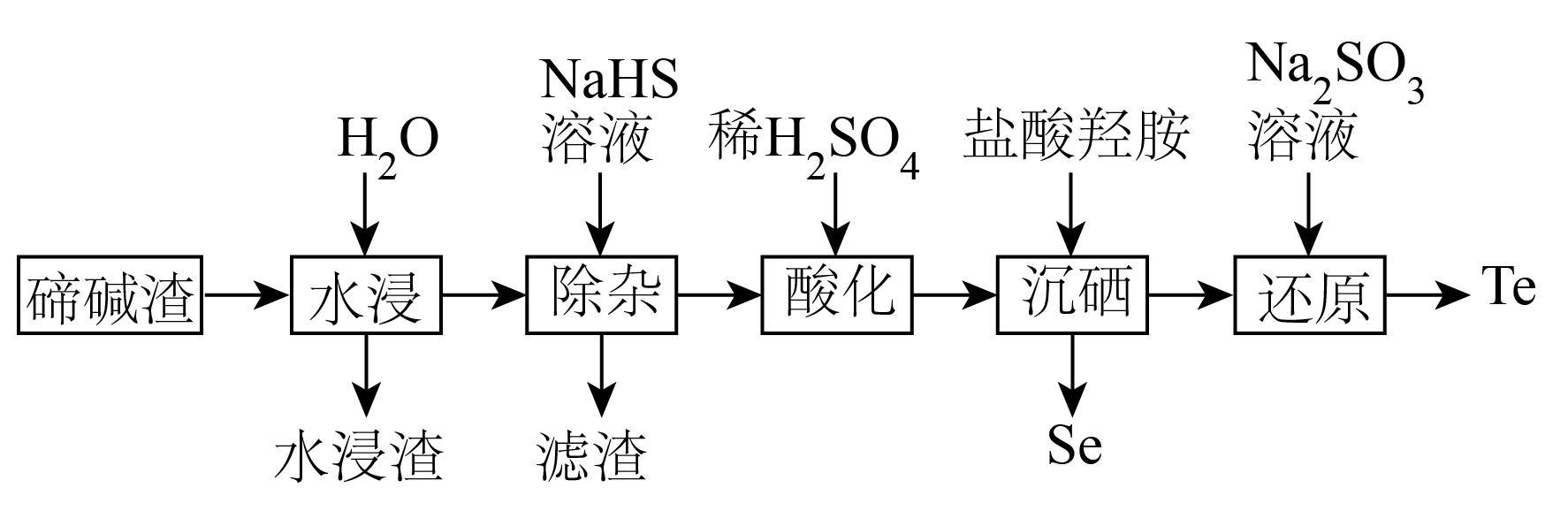
回答下列问题:
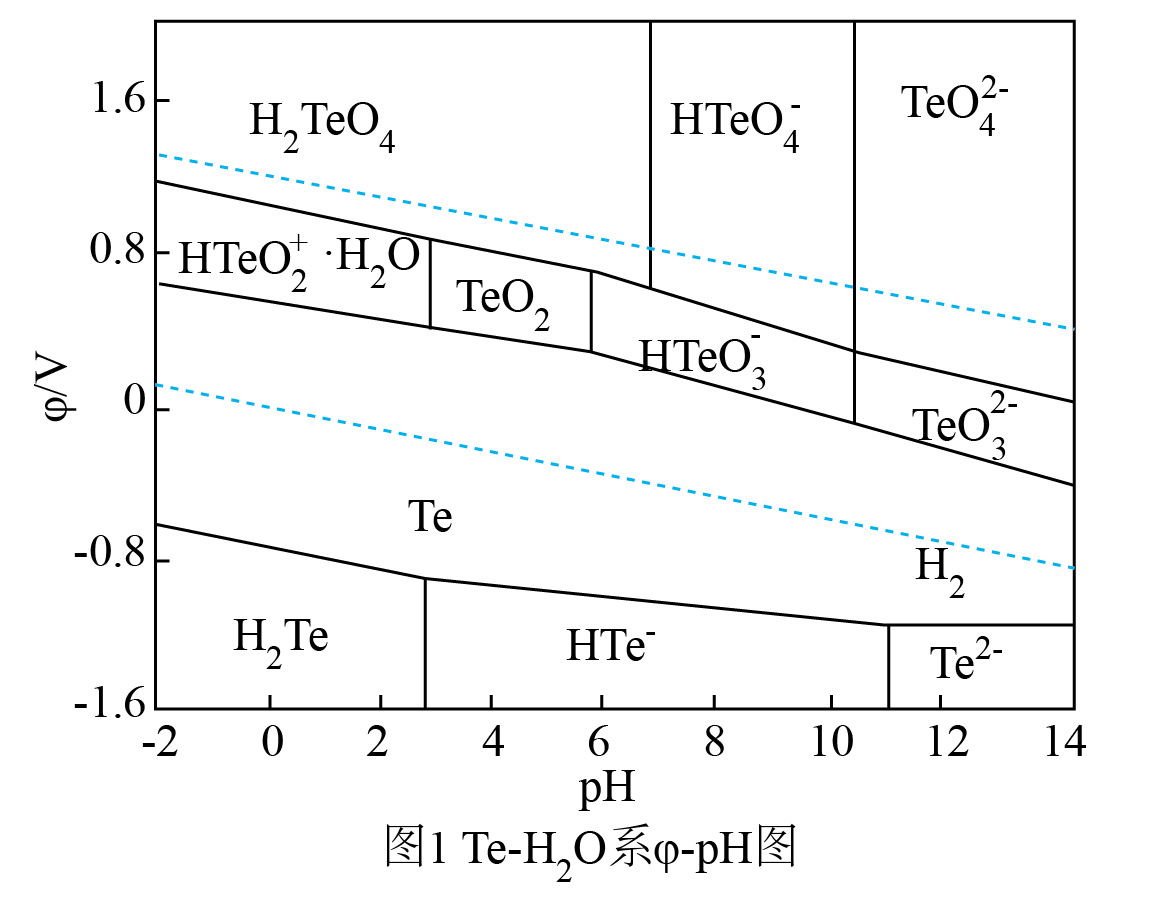
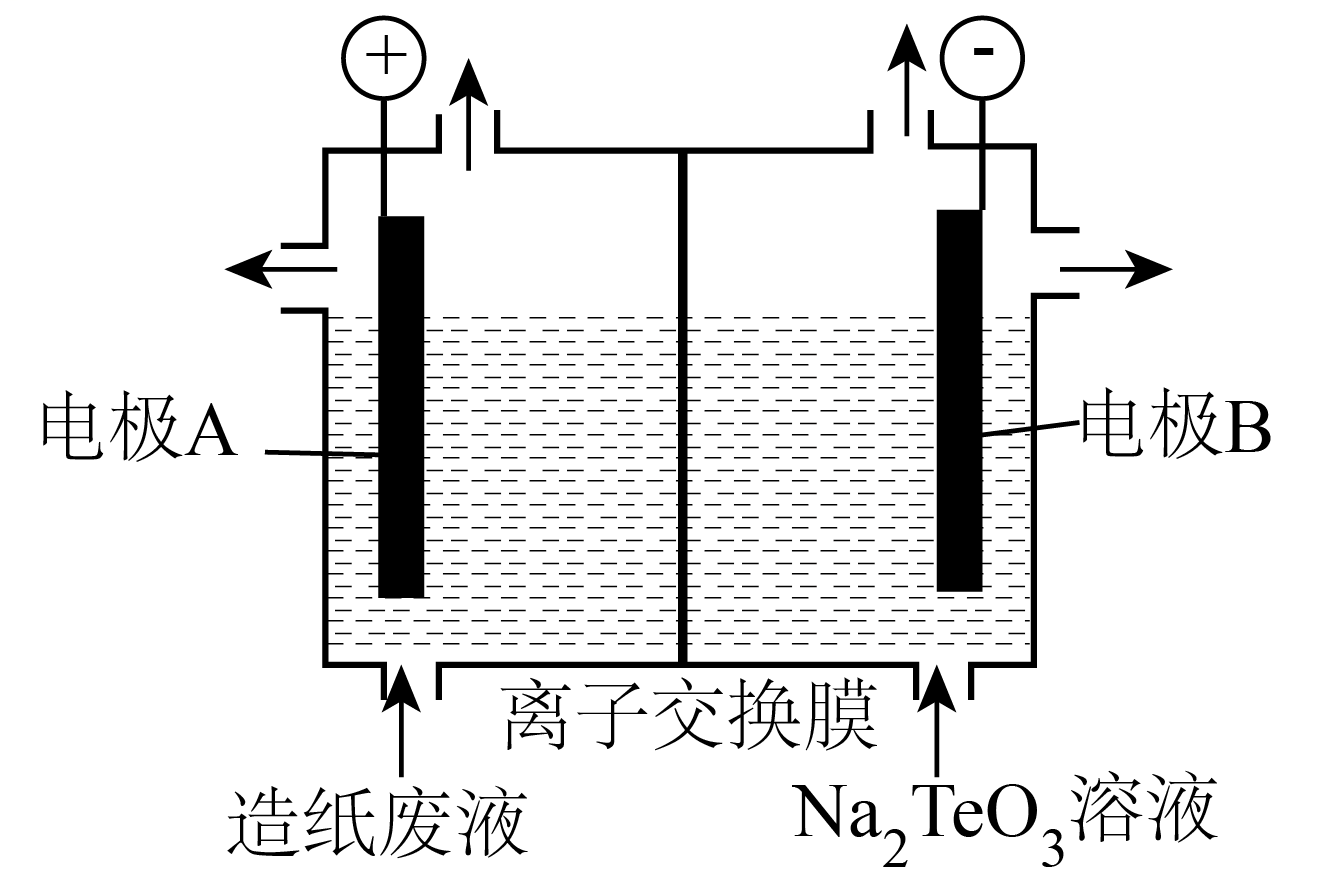

已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数
。
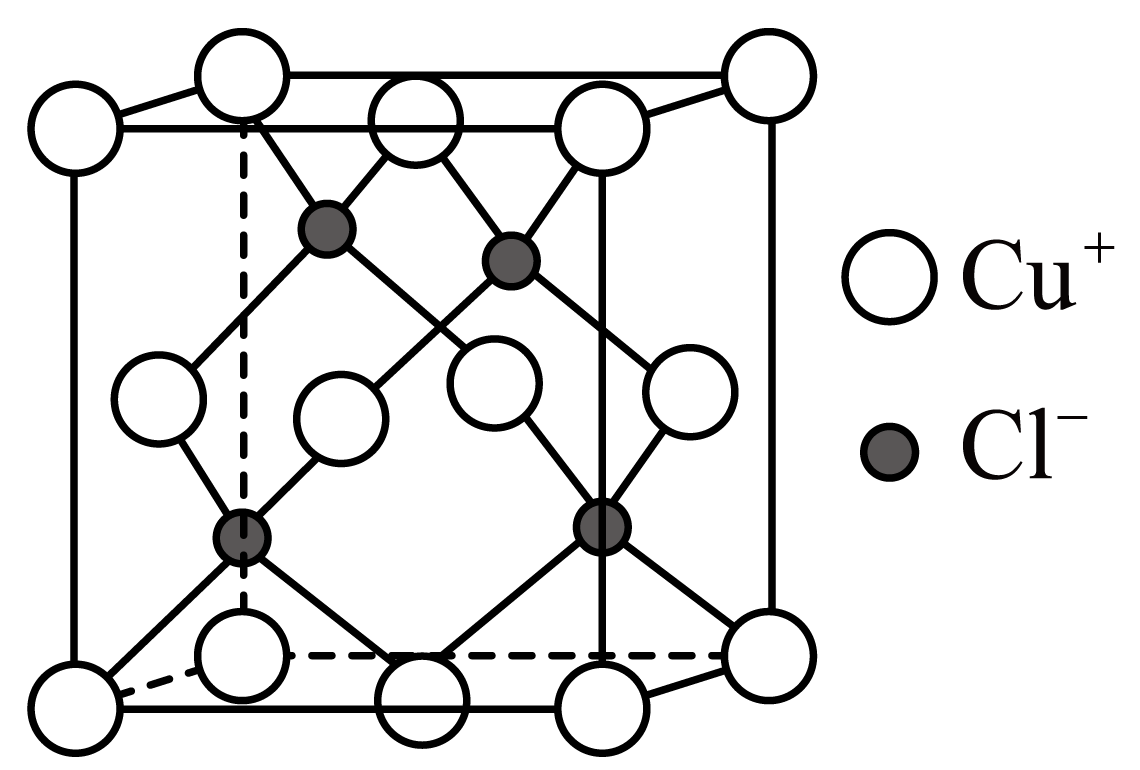
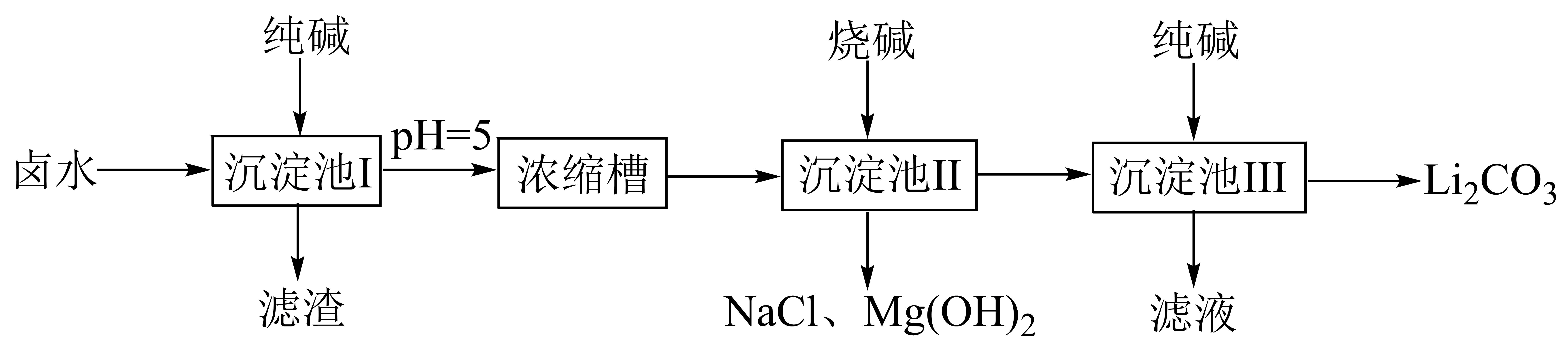
已知:
①卤水中、
;
。
②的溶解度随温度升高而降低。
③常温下,几种难溶物质的溶度积数据如下表:
物质 | |||||
下列说法错误的是( )