。(电负性:
)
下列说法正确的是。
A.原子半径:
B.GaAs为共价晶体,为分子晶体
C.沸点:
D.化学键中离子键成分的百分数:
②比较键角:
中的
中的
(填“>”“<”或“=”),请说明理由

如图所示晶胞沿着z轴的投影图为(填选项字母)。
A.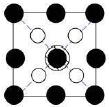 B.
B. C.
C.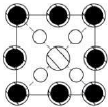 D.
D.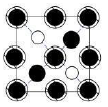
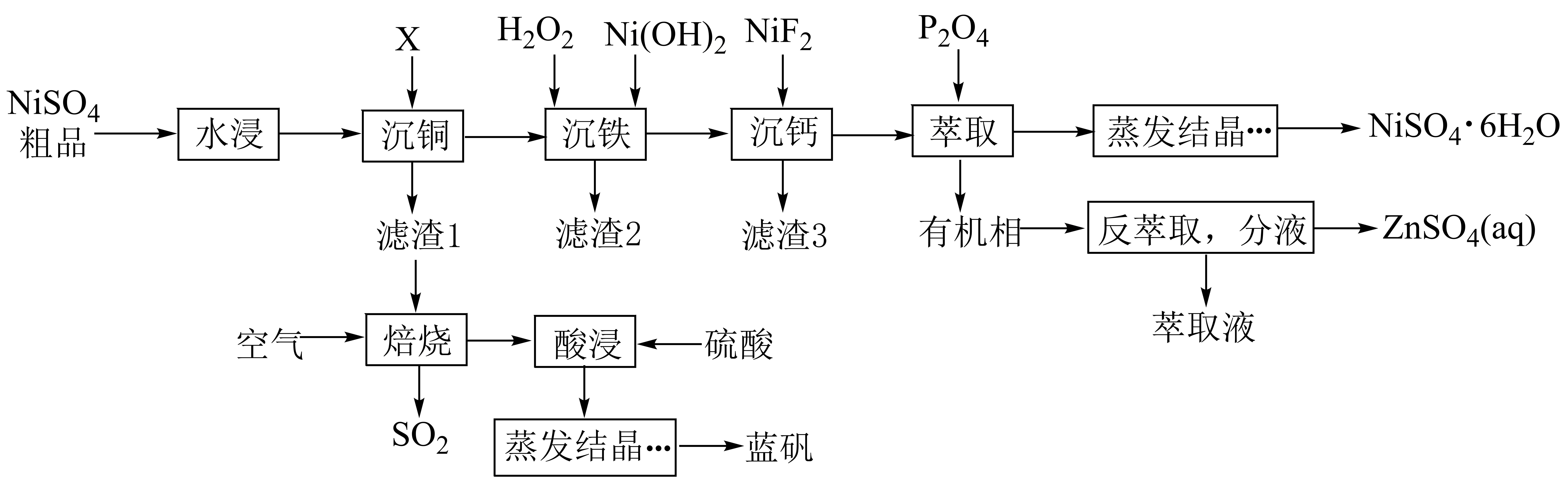
已知:常温下,①;
②部分金属离子(起始浓度为0.1 , 沉淀完全的浓度为
)生成氢氧化物沉淀的pH范围如下表:
金属离子 | ||||||
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 82 | 8.3 | 8.9 | 13.8 |
回答下列问题:
A.1.5 B.4.0 C.6.3 D.6.9
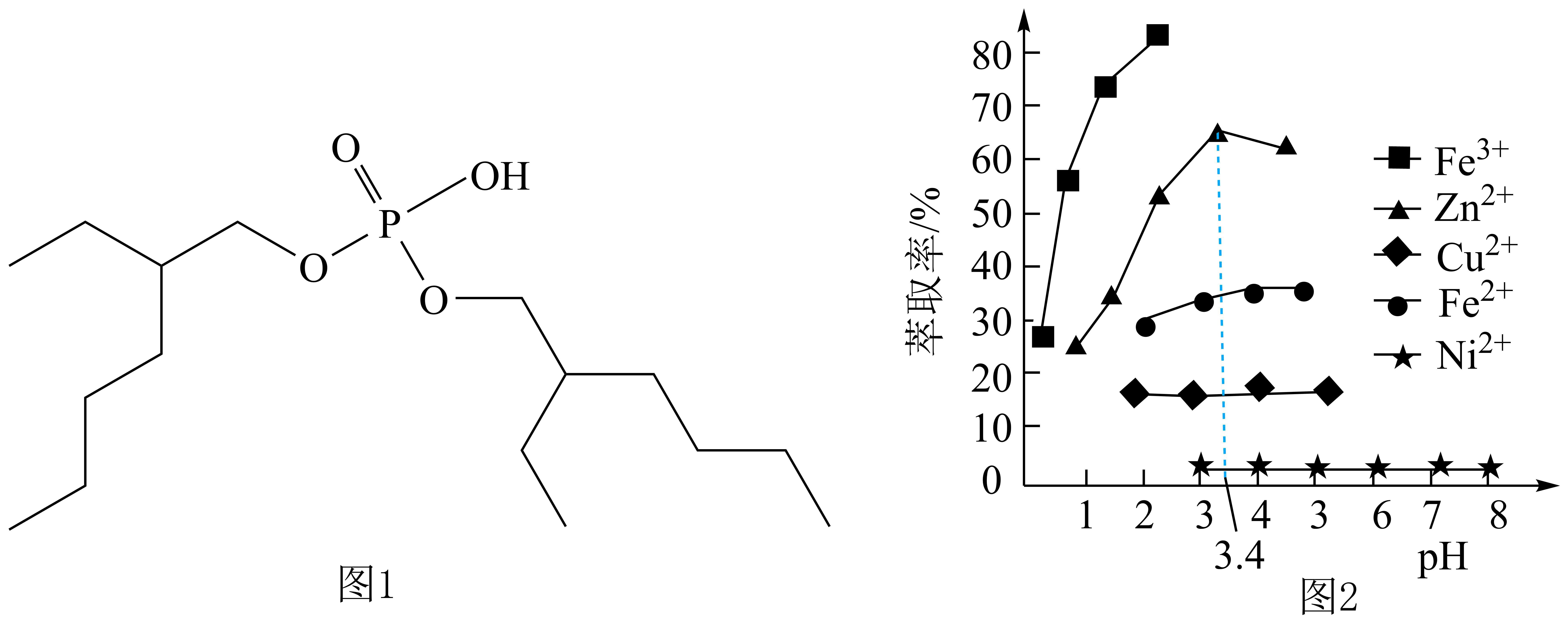
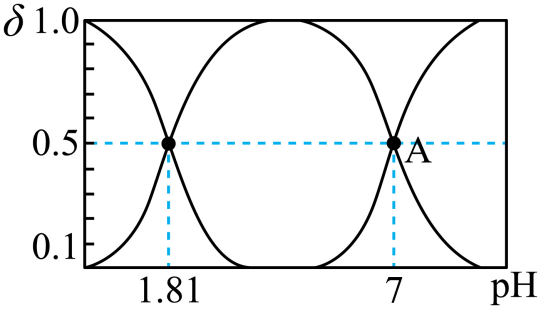
①A点溶液中离子浓度大小关系为。
②常温下,溶液呈性,原因是。
已知。回答下列问题:
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键


化合物 | ||||
熔点/℃ | 377 | 38.3 | 155 |
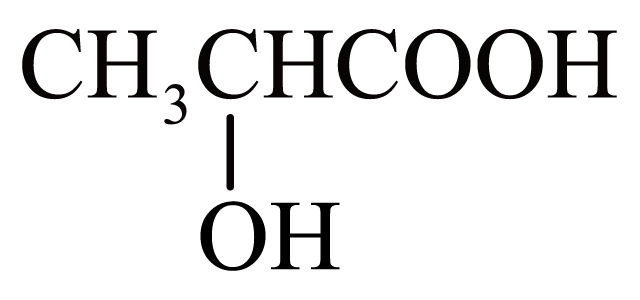 )分子中含有1个手性碳原子
D .
)分子中含有1个手性碳原子
D .