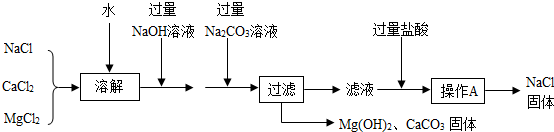
①图中A为池(填“蒸发”或“冷却”)。
②粗盐中含多种可溶性杂质(MgCl2、CaCl2和Na2SO4等)及不溶性杂质(泥沙),为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH溶液②Na2CO3溶液,③BaCl2溶液,加入试剂的先后顺序不合理的是。
A.①②③ B.②①③ C.③②① D.③①②
猜 想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 猜想Ⅰ成立 | |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 |
烧碱
小苏打
纯碱
熟石灰
向盛有氢氧化钠溶液的烧杯中滴入几滴无色酚酞溶液,再逐滴加入稀盐酸,观察到,说明发生了反应;
如图为氢氧化钠溶液与稀盐酸反应的微观示意图,该反应的微观实质是。


过滤使用的玻璃仪器有烧杯、玻璃棒和。
写出
溶液中溶质的化学式。
写出杂质
发生反应的化学方程式。
【实验一】粗盐提纯并计算精盐的产率(如图是粗盐提纯的实验操作)。

氯化钠在不同温度下的溶解度数据如下表所示。配制20℃时氯化钠的饱和溶液,需在25g水中至少加入NaClg,在量取水的体积时,应选用(选填“10”、“50”或“100”)mL量筒。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
NaCl的溶解度/ | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
温度/ ℃ | 0 | 10 | 20 | 30 | 40 | 50 |
溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
请回答下列问题:
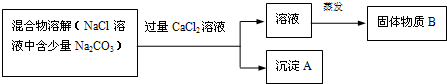
写出沉淀
的化学式 ;
加入
溶液后,分离除去沉淀
的实验操作方法是 ;
上述方案很容易引入新的杂质.于是改进方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去
杂质,又能有效地防止新杂质的引入.写出有关反应的化学方程式 .