
已知常温下部分物质的如表。
物质 | |||||
回答下列问题:
T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 4440 | 49.38 |
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是。
①验证该混合溶液中含有的方法及现象为。
②NaOH中存在的化学键为。
③将少量的氧化铝投入该混合溶液中,发生反应的化学方程式为。

长征系列运载火箭的燃料之一是肼(N2H4)。回答下列问题:肼的靡尔质量是,48g肼中含有氮原子的数目为。

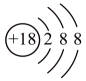
①的离子结构示意图为。
②表中几种元素的最高价氧化物对应水化物酸性最强的是(填化学式);写出该物质在水溶液中的电离方程式:。
③用电子式表示短周期元素中,原子半径最大的元素与氯形成的简单化合物的形成过程:。
④氰是一种无色、可燃气体,剧毒、有苦杏仁味,与卤素单质
![]() 性质相似,试写出氰与NaOH溶液在常温下反应的离子方程式:。
性质相似,试写出氰与NaOH溶液在常温下反应的离子方程式:。
①写出Se在周期表中的位置:。
②溶于水生成
, 向所得溶液中通入
气体发生反应,生成Se和
。写出
与
反应的化学方程式:。
a.原子半径:
b.中存在的化学键为非极性共价键
c.非金属性:Cl>Se>Br
① ②氢氧化钠固体 ③
④
⑤盐酸 ⑥酒精 ⑦熔融硝酸钾 ⑧液氯
已知能发生反应:
配平上述化学方程式,并在方程式上面用“双线桥”经明电子转移的方向和数目.