|
|
|
|
A.实验室收集乙烯 | B.分离乙醇和乙酸 | C.验证NH3易溶于水且溶液呈碱性 | D.除去CO2中混有的少量HCl |

已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数
。
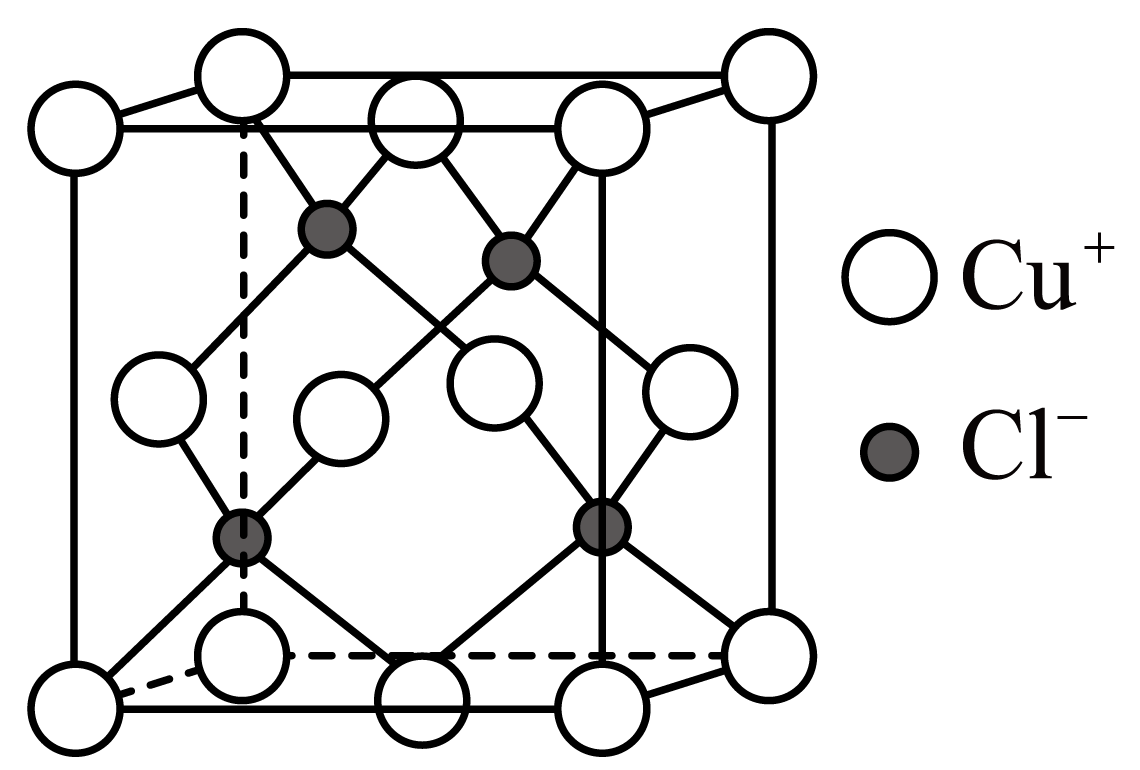

已知:①GeO2与碱反应生成Na2GeO3;AS2O3与碱反应生成NaASO2;
②GeCl4的熔点−49.5℃,沸点为85℃,极易发生水解

已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示;
金属离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀pH | 1.9 | 3.0 | 8.1 | 8.9 |
完全沉淀pH | 3.0 | 4.7 | 10.1 | 10.9 |
②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数δ与pH的关系如图所示,

回答下列问题:
②温度高于80℃时,沉钒率下降的原因是(任写一种)。

已知H3BO3微溶于水,易溶于乙醇:偏硼酸钠(NaBO2)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。下列说法错误的是( )


已知:①不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
等。
②盐酸羟胺常用作还原剂。
③在
时开始水解,
时
几乎完全水解为白色的
沉淀。
④常温下部分阳离子以氢氧化物形式沉淀时溶液的见下表:
金属离子 | |||
开始沉淀 | 2.7 | 7.6 | 4.7 |
完全沉淀 | 3.7 | 9.6 | 6.7 |
回答下列问题:
pH | 6.0 | 6.5 | 7.0 | 8.0 | 9.0 |
1.54 | 1.50 | 1.49 | 1.47 | 1.47 |
