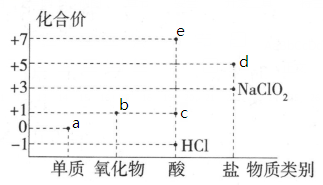
①臭氧和氧气互为(填“同位素”或“同素异形体”).
②生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是
③是一种新型含氯消毒剂,在自来水消毒领域已经开始使用.
中
元素的化合价为价.
④高铁酸钠还是一种新型的净水剂.其净水过程中所发生的化学反应主要为
(胶体)
, 证明有
胶体生成的实验操作为.
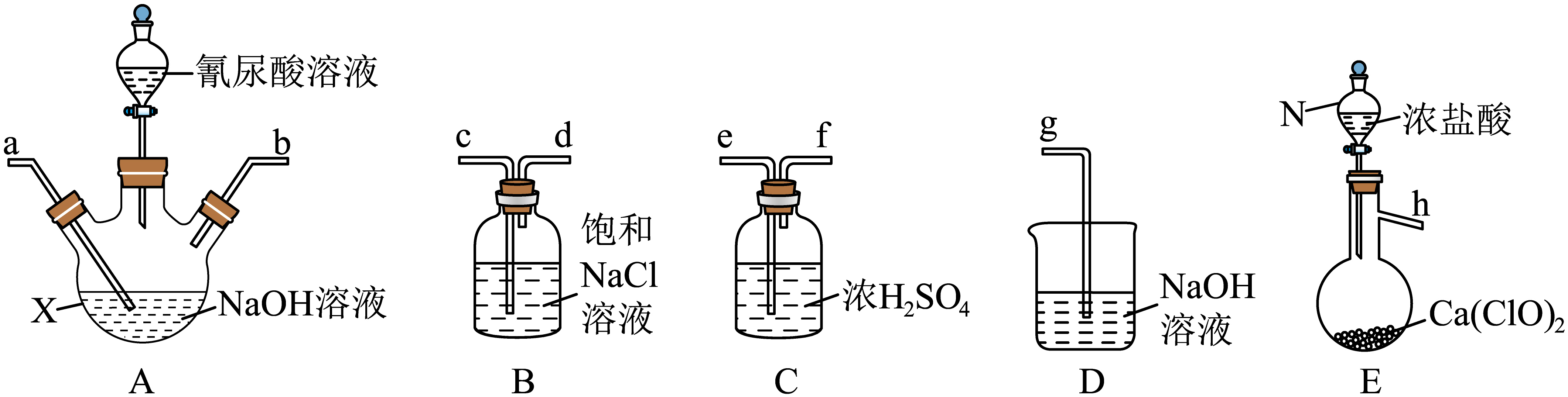
已知: , 回答下列问题:
h→→→→→
准确称取0.6000g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量溶液,密封在暗处静置5min;用
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
溶液15.00mL。
①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要。
②滴定至溶液呈微黄色时,加入的指示剂是,该样品的有效氯为%。(该样品的有效氯 , 保留三位有效数字)
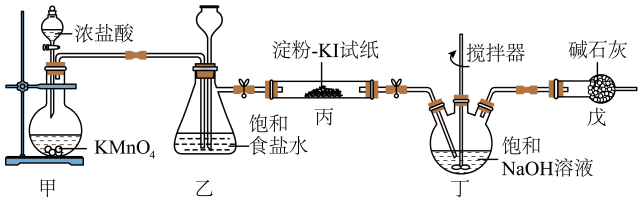
猜测1:双氧水与消毒液发生反应产生氧气
猜测2:……
①猜测1中反应的化学方程式为;猜测2可能为。
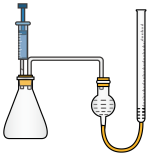
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到,则证明猜测1正确。

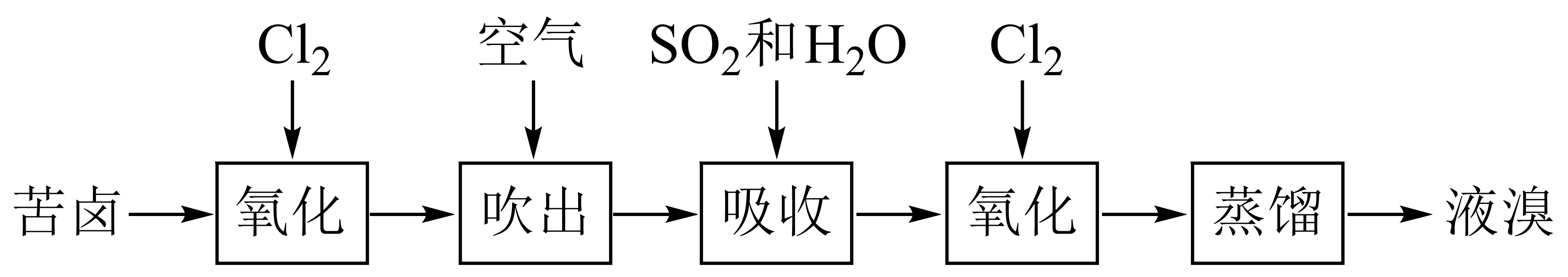
以苦卤为原料提Br2而不是直接利用海水提Br2 , 优势在于。
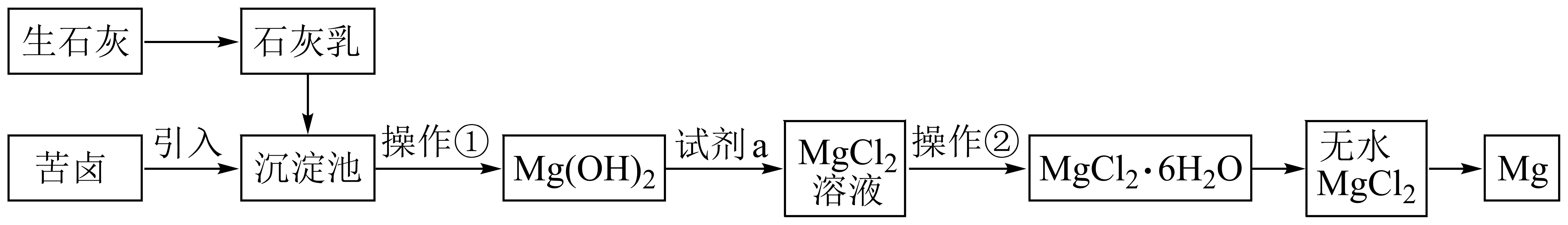
已知:MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
沉淀池中发生主要反应的离子方程式为。
a.N2 b.Ar c.CO2 d.O2
A. B.
C.
D.
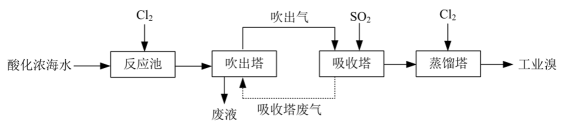
吸收塔中与
反应的离子方程式为。

Ⅰ.的一种制备方法如下图所示:


已知:①;
②碘微溶于水,从左右开始升华;
的沸点是
。
海带浸取原液在酸性条件下被氧化的离子方程式是。