
①“氧化”时在微生物的催化作用下,被氧化为
。该反应的化学方程式为。
②“沉淀”中将“氧化”步骤后剩余的转化为
沉淀,发生反应的离子方程式为。
③若调节pH过大,会降低氨氮去除率,其原因为。
生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。

图-1
①硝化过程中溶液的pH。(填“升高”或“降低”)。
②每处理含的酸性废水,理论上消耗
的物质的量为。
最近我国科学家开发了如图-2所示电解装置,可将氨氮氧化去除。处理前先调节废水 , 通电后可将其转化为无害气体。

图-2
请结合电极反应式简述其去除氨氮的化学原理。


I.自然界中氮的循环(如图所示)

![]()
①过程I:加NaOH溶液,调节pH至9后,升温至30℃,通入空气将氨赶出并回收。加入NaOH溶液时,所发生反应的离子方程式为。
②过程II:在微生物作用下实现的转化,称为硝化过程。在碱性条件下,
被氧气氧化为
的总反应的离子方程式为。

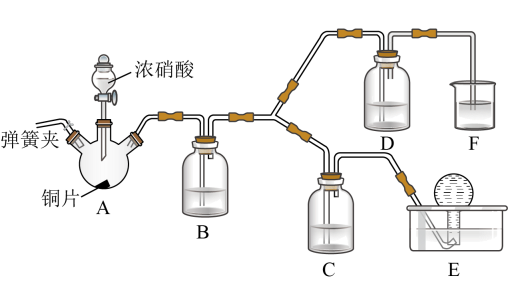
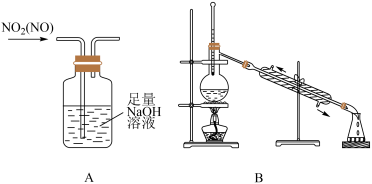
已知:NaOH溶液不与NO反应,能与NO2反应。
①浓硝酸应保存在棕色试剂瓶中,用化学方程式解释其原因为。
②装置A中发生反应的化学方程式为;装置B的作用为。
③装置D中的现象为;C中盛放的试剂为。