
已知pOH=−lgc(OH-)。
已知:①[ , X为
、
、
或
]
②(
、
、
)
下列叙述错误的是( )


下列说法正确的是( )
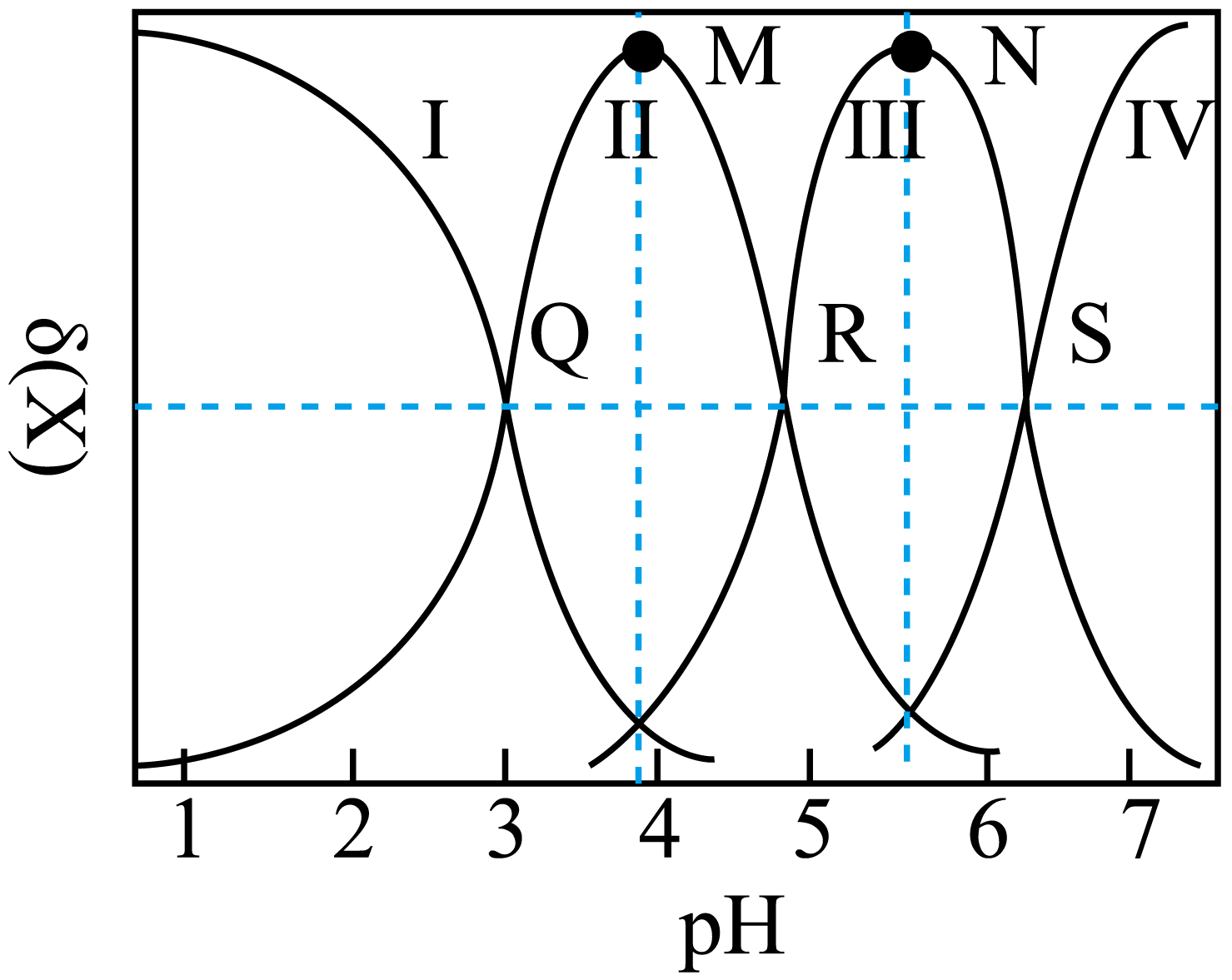
25℃时,不同pH范围内,H3Cit、H2Cit-、HCit2-和Cit3-所占的比例(该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表HCit2-的是____。

请写出离子反应方程式,并标出电子转移的方向和数目。。

已知常温下:Ksp[Al(OH)3] = 1.3×10-33 , Ksp[Fe(OH)2] = 4.9×10-17 , Kb[NH3•H2O] = 1.8×10-5。
基态Fe原子价电子排布式为。