|
|
|
|
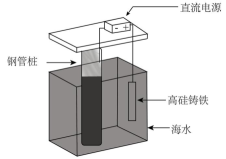
A.测定锥形瓶中污水样品中c(OH-) | B.制备O2 | C.验证牺牲阳极法保护铁 | D.关闭a,打开b,可检查装置的气密性 |
实验Ⅰ
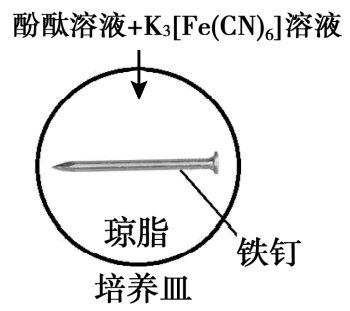
5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
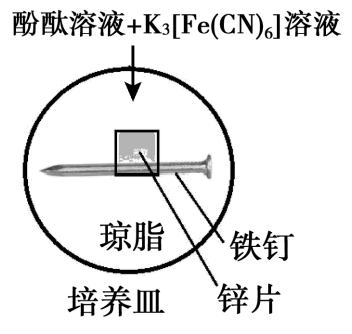
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是( )
图1  图2
图2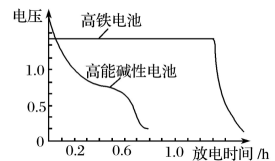
①该电池放电时正极反应式为。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向(填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有。
甲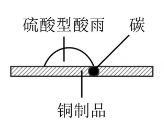 乙
乙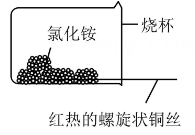
①如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生(填“氧化”或“还原”)反应,写出正极的电极反应式:。
②如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
生成,写出由黑色变为光亮红色过程中反应的化学方程式:。
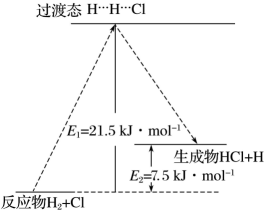
该基元反应的活化能为kJ/mol,为kJ/mol。
化学键 | ||||
键能/(kJ/mol) | 172 | 335 | 498 | X |
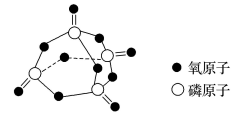
已知白磷的标准燃烧热为-2378kJ/mol,白磷的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中。
化学键 | H-H | N≡N |
键能/(kJ/mol) | a | b |
试回答下列问题:已知
,
则N-H键的键能是kJ/mol(用含有a、b、c的式子表示)。
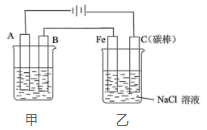
Ⅲ.如下图所示装置中都盛有0.1mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是。

|
|
|
|
① | ② | ③ | ④ |