反应i.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H1
反应ii.CO2(g) + H2(g) CO(g) + H2O(g) △H2= + 41.2 kJ·mol-1
回答下列问题。

① 0~10 min内,平均反应速率v (CH3OH) =mol·L-1·min-1。
② T℃时,反应ii的化学平衡常数K =。
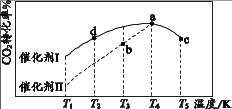
①图中达到化学平衡状态的是(填“a”“b”“c” “d”)。
② 其他条件相同,若将原料气按n (CO2):n(H2)=1:2.8充入同一恒容、密闭容器中,在催化剂I的作用下发生反应。该条件下,a点时CO2的转化率(填“增大”或“不变”或“减小”)。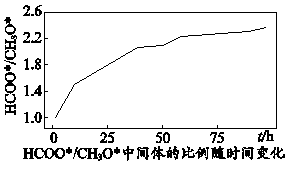
与
物质的量之比随时间变化图如下:
第一步
第二步
第三步
下列说法正确的是。
A.其他条件相同时,升高温度时,三步反应速率均加快
B.用不同催化剂催化反应可以改变反应历程,提高平衡转化率
C.反应历程中,第二步反应的活化能最高,是反应的决速步骤
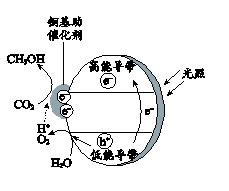
ⅰ.
ⅱ.
kJ⋅1mol
ⅲ.
kJ⋅mol
计算kJ⋅mol
, 该反应在(填“低温”“高温”或“任意温度”)条件下能自发进行。

①在0~4 min时段,的平均反应速率
,该反应在上述温度下的平衡常数
(保留1位小数)。
序号 | 反应试剂 | 体系温度 | ||
反应前 | 反应后 | |||
i |
|
| a | b |
ii |
| a | c | |
溶液比热容取 , 溶液的密度取
, 忽略溶液体积、质量变化以及水以外各物质吸收的热量.下列说法不正确的是( )
化学键 | N-H | N-Cl | H-Cl |
键能 | 391.3 | x | 431.8 |

则反应过程中的△H2=kJ·mol-1 , 表中的x=。

①a、b、c三点对应平衡常数的大小关系是(分别用Ka、Kb、Kc表示)。b点时,该反应的平衡常数为;
②T2℃,Q点对应的速率:(填“>”、“<”或“=”);
③在氨氯比一定时,提高NH3的转化率的方法是(任写1种);
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是。

Ⅰ.
Ⅱ.

已知:的选择性=
×100%
①下列能说明体系已达到平衡状态的是。
A.混合气体的密度不再变化
B.混合气体的总压强不再变化
C.的物质的量不再变化
②温度高于300℃时,平衡转化率随温度升高而上升的原因:。