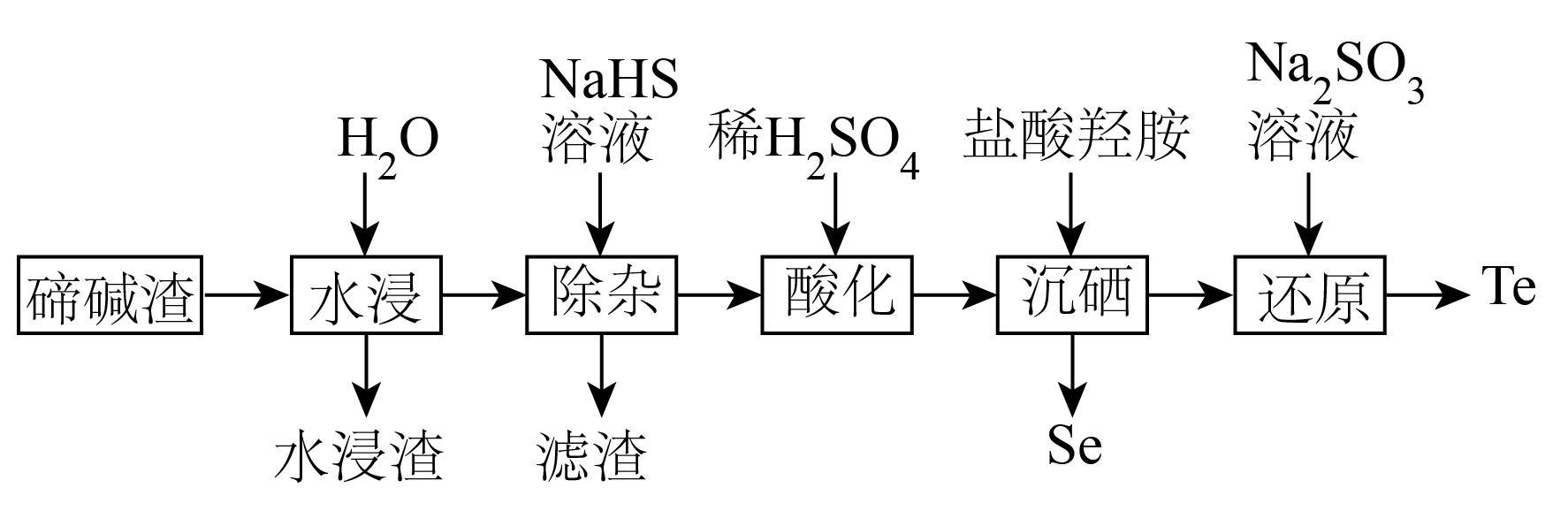
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
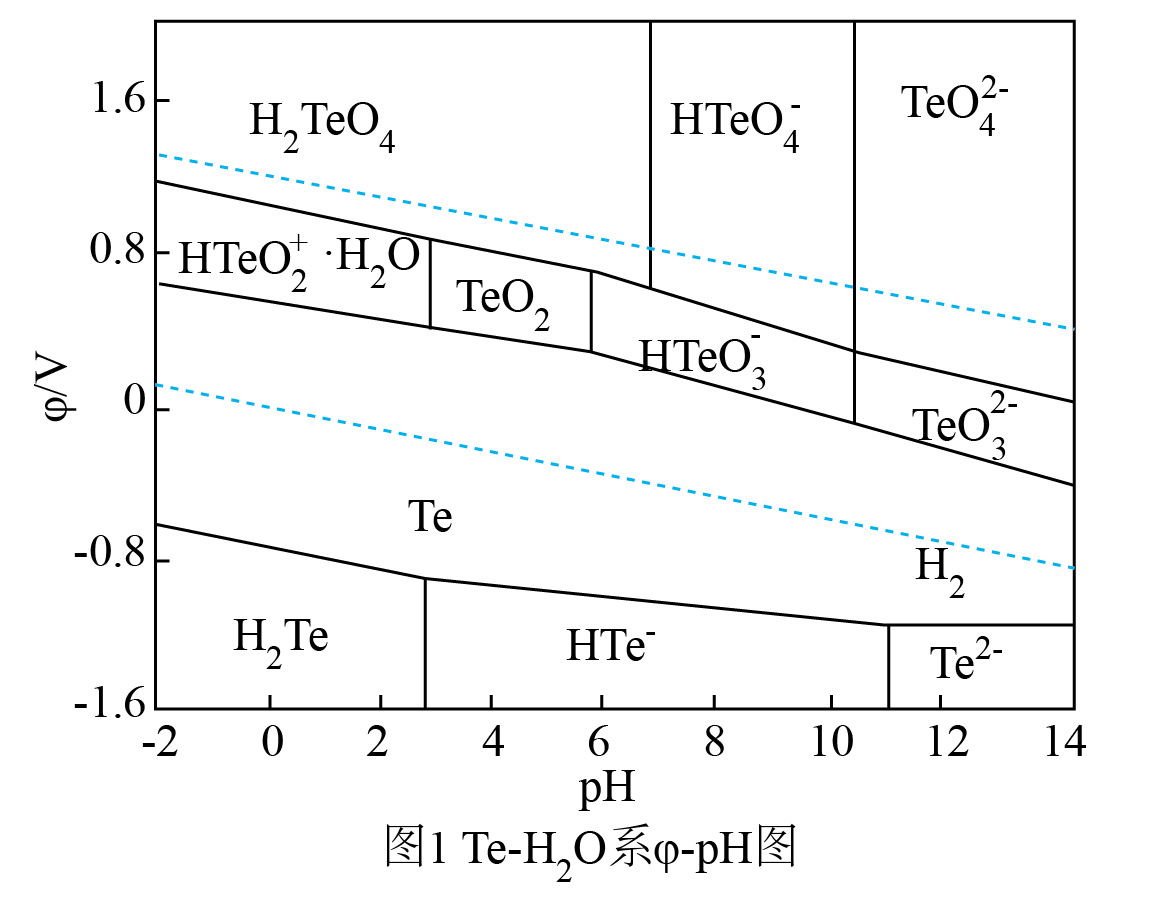

①已知:I.
Ⅱ.
甲烷化反应Ⅲ.
的
, 平衡常数
(用
表示)。
②加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为。
A.反应速率快 B.平衡转化率高 C.催化剂活性高 D.主反应催化剂选择性好

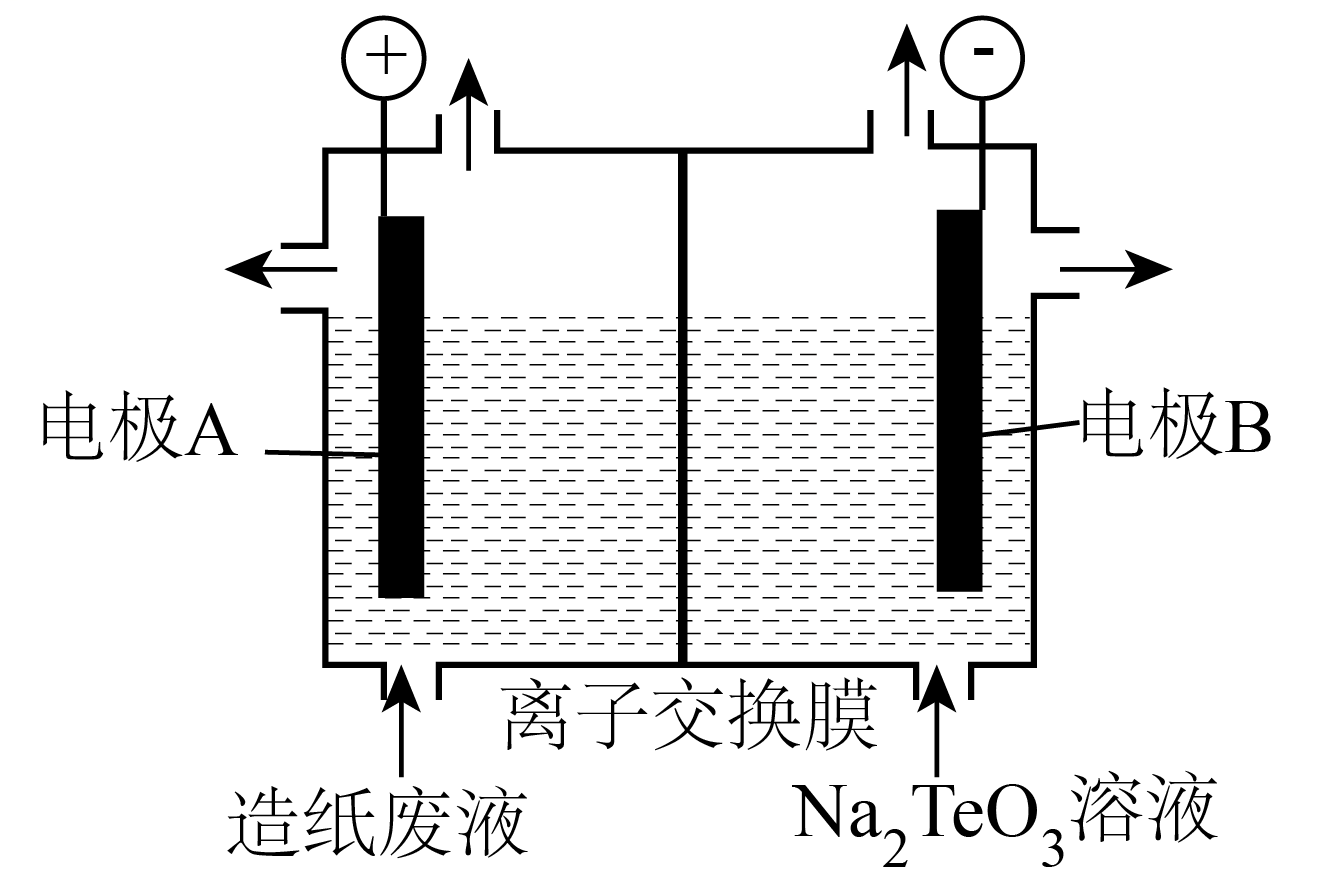
①上述两种不同机理发生机制![]() 关键为:
关键为:和
在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则
吸附在上。
②机理①和②都会产生中间体。其产生的原因可能是或吸附在载体
的
原子表面的(
衍生物中间体)甲酸盐解离产生。
③中间体Ⅱ转化为中间体Ⅲ的过程可用反应式表示为。
①此反应在(填“高温”、“低温”或“任何温度”)下能自发进行。
②我国学者研究发现,在单原子催化时,该反应的历程为:
第一步
第二步
第三步
中间体与
物质的量之比随时间变化如下图:

回答下列问题:
i.基态铜原子价层电子轨道表达式:。
ii.反应历程中,第步反应的活化能最高,是反应的决速步聚,判断的理由是。
 B . 顺式聚2-甲基-1,3-丁二烯的结构简式:
B . 顺式聚2-甲基-1,3-丁二烯的结构简式: C . NaH的形成过程:
C . NaH的形成过程: D . 邻羟基苯甲醛的分子内氢键:
D . 邻羟基苯甲醛的分子内氢键:
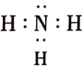 D .
D . 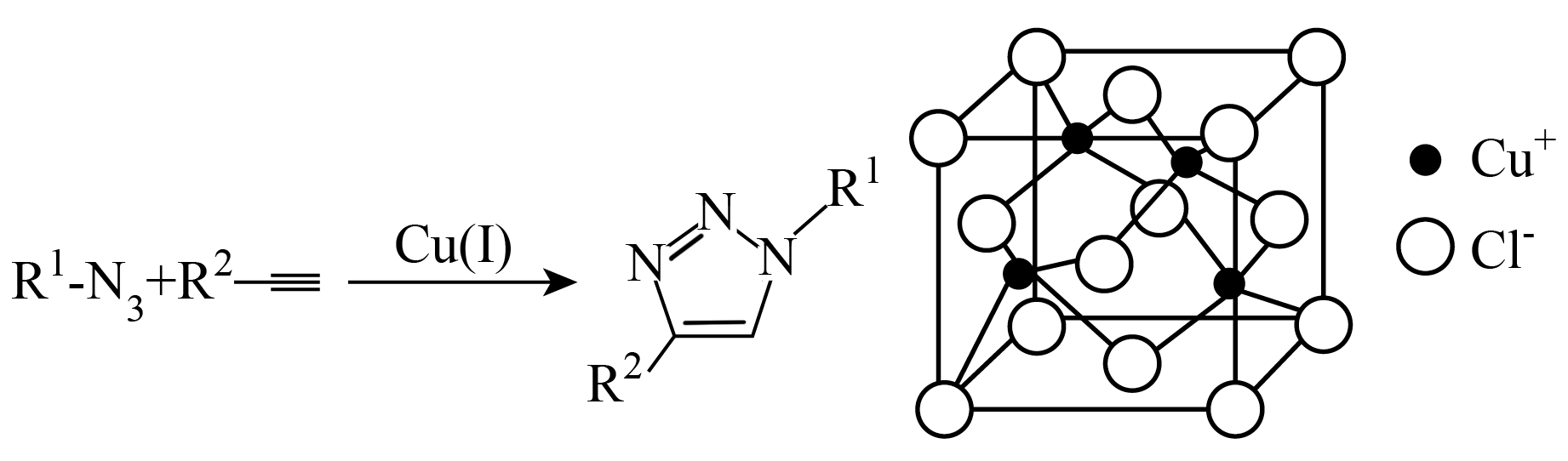

已知:①在
时开始水解,
时几乎完全水解为白色的BiOCl沉淀;
②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
金属离子 | ||
开始沉淀的pH | 1.9 | 7.2 |
沉淀完全的pH | 2.9 | 8.2 |

 B .
B .  的名称:乙二酸乙二酯
的名称:乙二酸乙二酯

|
|
|
图a | 图b | 图c |
写出图c所示阴离子的化学式。
化学键 | ||||||
键能/ | 348 | 615 | 812 | 413 | 226 | 318 |
键长/ | 154 | 133 | 120 | 109 | 235 | 150 |
硅与碳同族,也有系列含氢化合物,但硅的含氢化合物在种类和数量上都远不如碳的含氢化合物多,试从共价键的成键角度解释原因。
