

①晶胞中每个氮原子周围与其最近且等距离的硼原子有个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中,B原子的坐标参数分别有:B (0,0,0);B( , 0,
);B (
,
, 0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为;
 , 下列叙述错误的是( )
, 下列叙述错误的是( )
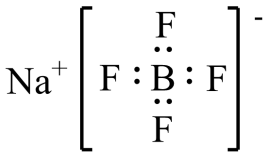 D . [Amim]BF4可作为电解质用于电池中
D . [Amim]BF4可作为电解质用于电池中
 C .
C .  C . 任何晶体中,若含有阳离子就一定有阴离子
D .
C . 任何晶体中,若含有阳离子就一定有阴离子
D . ① 3p轨道上只有一对成对电子的原子 ② 外围电子构型为2s22p5的原子;
③ 其3p轨道为半充满的原子 ④ 正三价的阳离子结构与氖相同的原子。
则下列有关比较中正确的是( )




①基态的3d电子轨道表示式为。
②的配位原子是,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是。
Ⅰ.
Ⅱ.
①反应
。
②不同温度下氨催化氧化的平衡常数如下();
温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( | 6.3×1041 | 1.1×1026 | 21×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
下列说法正确的是。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
第一步:
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
, 在一定条件下反应进行到10 min时,测得
和尿素的物质的量均为0.25 mol,15 min后,测得
的物质的量为0.1 mol,如图所示。
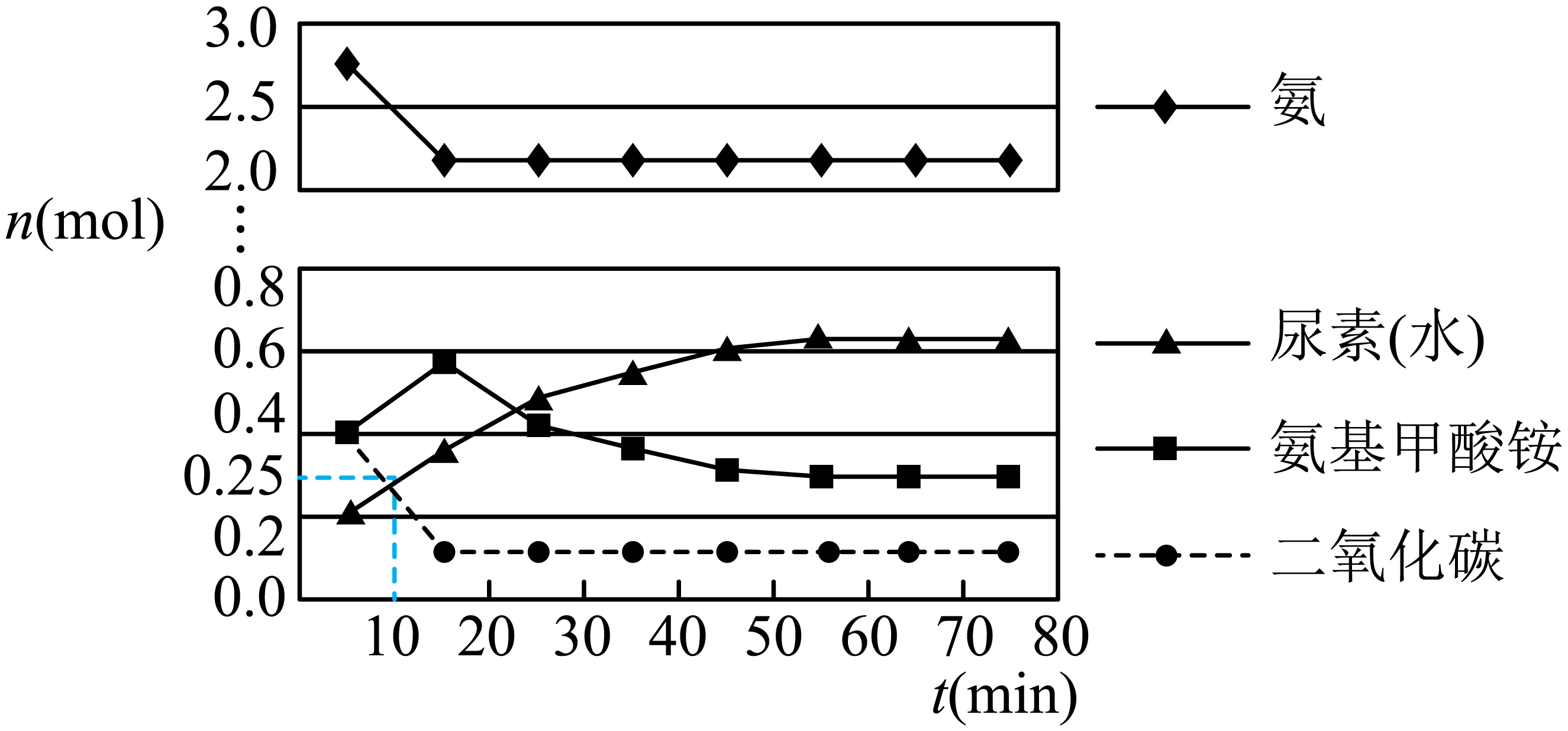
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成(氨基甲酸铵)的平均反应速率为。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是,第一步反应的平衡常数(列出算式即可)。