 B . 顺式聚2-甲基-1,3-丁二烯的结构简式:
B . 顺式聚2-甲基-1,3-丁二烯的结构简式: C . NaH的形成过程:
C . NaH的形成过程: D . 邻羟基苯甲醛的分子内氢键:
D . 邻羟基苯甲醛的分子内氢键:
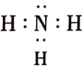 D .
D . 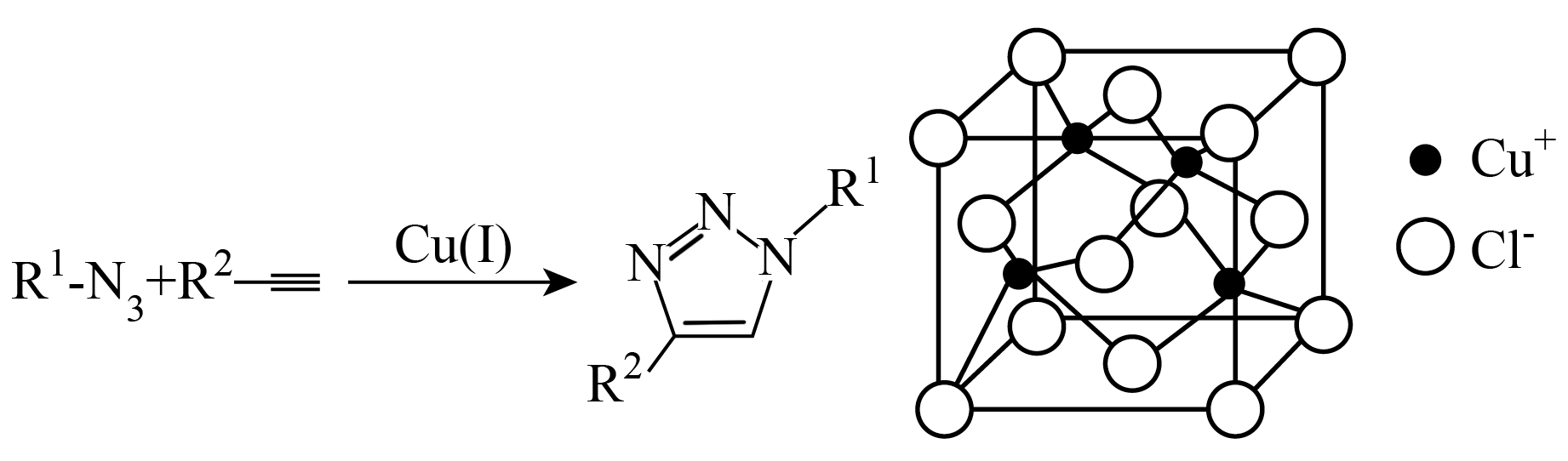

已知:①在
时开始水解,
时几乎完全水解为白色的BiOCl沉淀;
②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
金属离子 | ||
开始沉淀的pH | 1.9 | 7.2 |
沉淀完全的pH | 2.9 | 8.2 |

 B .
B . 
|
|
|
图a | 图b | 图c |
写出图c所示阴离子的化学式。
化学键 | ||||||
键能/ | 348 | 615 | 812 | 413 | 226 | 318 |
键长/ | 154 | 133 | 120 | 109 | 235 | 150 |
硅与碳同族,也有系列含氢化合物,但硅的含氢化合物在种类和数量上都远不如碳的含氢化合物多,试从共价键的成键角度解释原因。



①非金属元素电负性由大到小的顺序为。
②氢氧原子间存在作用。
③的配位数为。
④已知:和N位于同一平面。可采用配合物的杂化轨道理论进行解释:
原有d电子可违反洪特规则进行重排,再利用外层空轨道杂化后接受N原子提供的孤对电子。则推测
采用的杂化轨道类型为(填字母标号)。
A. B.
C.
D.

已知立方晶胞边长为acm,阿伏加德罗常数为。
①该晶体类型为,Cu与Cu之间的最近距离为pm。
②该晶体密度为(用含
、a的式子表示)。

①分子组成中电负性最大的元素是;依据洪特规则简答:基态时N原子的电子排布应满足。
②分子中N原子的杂化方式有,共有个手性碳原子(即连有四个不同的原子或基团的碳原子);该添加剂具有性(选填“酸”,“碱”或“中”),从化学键变化的角度阐释具有该性质的原因:。

③氧离子的配位数为,A的氧化物的化学式为。
④当晶胞中有一半的An+离子被Bn+离子取代时,晶体的密度(A、B的摩尔质量分别为
、
,
代表阿伏加德罗常数的值)。