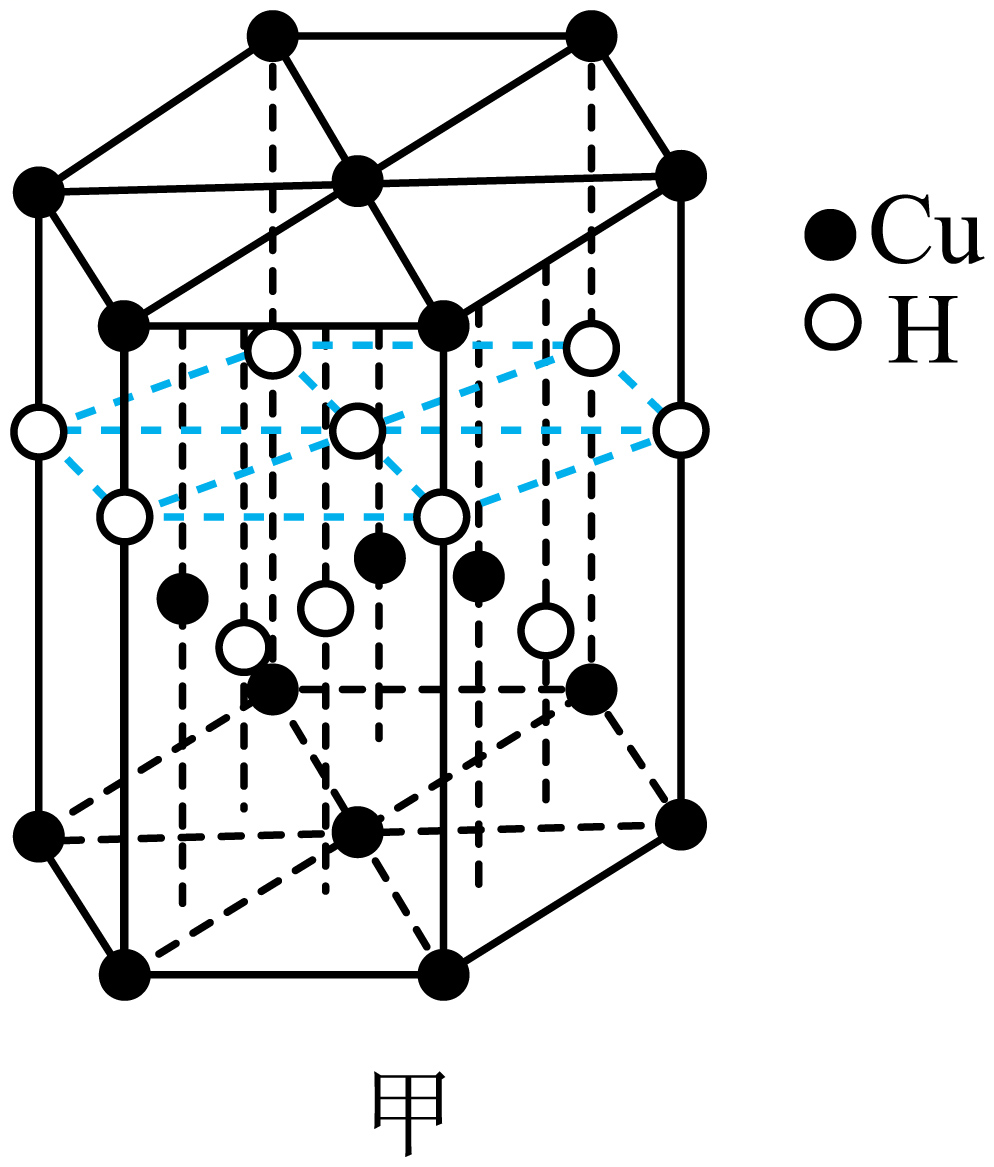

①基态铜原子的核外电子有种空间运动状态。与Cu元素同周期,基态原子有2个未成对电子的金属元素有种。
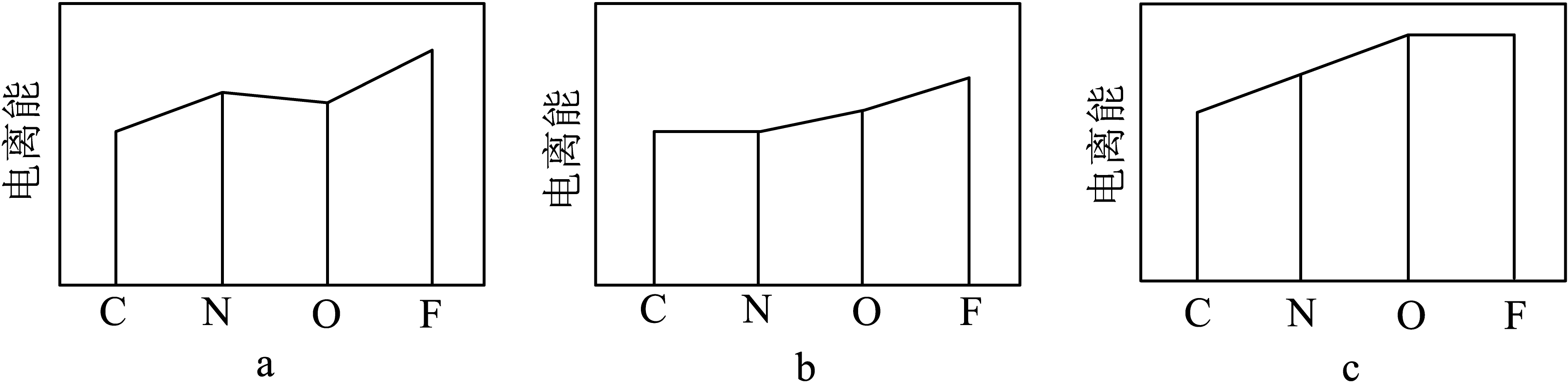
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填序号),第三电离能的变化图是(填序号)。
③化合物X中的中心铜离子的配位数是,图乙反应中断裂和生成的化学键有(填序号)。
a.离子键 b.键 c.极性键 d.氢键 e.配位键
②最外层电子数是次外层电子数3倍的元素是,其轨道表示式为。
③Cu原子的结构示意图为。


①晶胞中每个氮原子周围与其最近且等距离的硼原子有个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中,B原子的坐标参数分别有:B (0,0,0);B( , 0,
);B (
,
, 0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为;